
| 物质的化学式 | CH3COOH | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
| c(CH3COO-) |
| c(CH3COOH) |
| △n |
| V |
| △c |
| t |
| 1mol/L |
| 4 |
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| c(CH3COO-) |
| c(CH3COOH) |


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:阅读理解
 (2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.
(2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.| 物质的化学式 | CH3COOH | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
| c(CH3COO-) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省惠州市高考模拟考试理综化学试卷(解析版) 题型:计算题
工业上“固定”和利用CO2能有效地减轻“温室’效应。有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g) 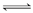 CH3OH(g)+H2O(g)
ΔH =-49.0 kJ·mol-1
CH3OH(g)+H2O(g)
ΔH =-49.0 kJ·mol-1
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是
A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
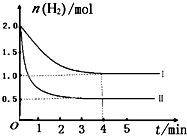
(2)一定温度时将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。
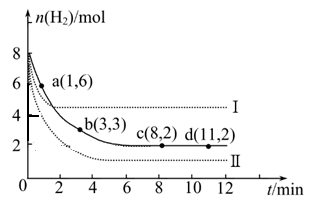
① a点正反应速率 逆反应速率(填“大于”、“等于”或“小于”)。
② 仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
③ 在题给图中绘出加入催化剂对应的曲线。
④ 结合图给实线的数据,计算该温度时反应的化学平衡常数。(写出计算过程)
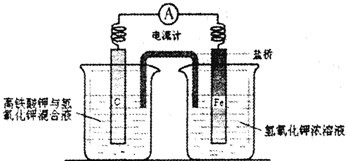
(3)甲醇可用以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源:2013年山东省临沂市高考化学三模试卷(解析版) 题型:解答题
| 物质的化学式 | CH3COOH | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
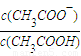 =______.
=______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com