
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
分析 设金属A、B、C再化合物中的化合价分别为x、y、z,金属的物质的量均为n,利用电子守恒得出关系式,再结合VB=2VC,且VA=VB+VC分析金属A在化合物中的化合价.
解答 解:设金属A、B、C再化合物中的化合价分别为x、y、z,金属的物质的量均为n,
由电子守恒可知,
nx=$\frac{{V}_{A}}{22.4L/mol}$×2,
ny=$\frac{{V}_{B}}{22.4L/mol}$×2,
nz=$\frac{{V}_{c}}{22.4L/mol}$×2,
已知VB=2VC,则11.2ny=22.4nz,即y=2z,
且VA=VB+VC,11.2nx=11.2ny+11.2nz,
x=y+z,所以x=3z,
z=1,y=2,x=3符合,
则在A的生成物中,该金属元素的化合价为+3价,
故选C.
点评 本题考查学生利用金属与酸的反应计算元素的化合价,明确电子守恒及体积关系是解答本题的关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
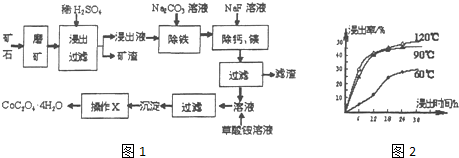
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
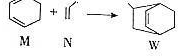 下列说法正确的是( )
下列说法正确的是( )| A. | W的分子式为C9H12 | |
| B. | N分子的所有原子在同一平面上 | |
| C. | M的二氯代物有8种(不考虑立体异构) | |
| D. | M、N、W均可发生氧化反应、还原反应和加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17L | B. | 20L | C. | 21L | D. | 23L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用化学反应可实现12C到14C的转化 | |
| B. | 天然气、煤气大量泄漏遇到明火会爆炸 | |
| C. | 大量使用燃煤发电是形成雾霾的主要原因 | |
| D. | 晶体硅可用作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
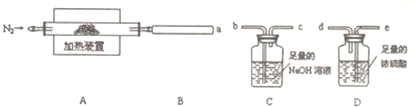
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
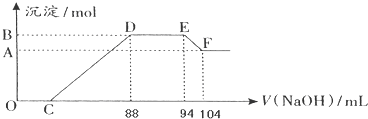
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com