
【题目】(1)用离子方程式解释:盛纯碱溶液的试剂瓶有玻璃塞,时间久了不易打开_____________。
(2)某同学想把AlCl3(aq)和Na2S(aq)混合制取A12S3,但最后得到一种白色絮状沉淀,而且混合液中有臭鸡蛋气味的气体放出。试解释造成此结果的原因,写出反应的离子方程式___________________。
(3)同温度下,具有相同 NH4+浓度的 NH3 ·H2O, NH4CI,CH3COONH4, NH4Fe(SO4)2 中,溶质浓度由大到小的顺序为_____________。
(4)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4C1溶液、盐酸和NaNO3溶液中的一种。己知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同。则:B是 溶液,C是_____________。
【答案】⑴CO32-+H2O![]() HCO3-+OH-(1分)
HCO3-+OH-(1分)
SiO2+2OH-=SiO32-+H2O(1分)
⑵2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑(2分)
⑶①>③>②>④(2分)
⑷CH3COONa(2分)盐酸(2分)
【解析】
试题分析:(1)碳酸钠水解溶液显碱性,生成的氢氧根与二氧化硅反应生成黏性很强的硅酸钠,而不易打开,所以盛纯碱溶液的试剂瓶用玻璃塞,时间久了不易打开,有关反应的离子方程式为CO32-+H2O![]() HCO3-+OH-、SiO2+2OH-=SiO32-+H2O。
HCO3-+OH-、SiO2+2OH-=SiO32-+H2O。
(2)硫离子和铝离子水解相互促进生成氢氧化铝和H2S,反应的离子方程式为2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。
(3)醋酸根水解显碱性,促进铵根水解。铁离子水解显酸性,抑制铵根水解,一水合氨是弱电解质,电离程度很小,则同温度下,具有相同 NH4+浓度的 NH3·H2O、NH4CI、CH3COONH4、NH4Fe(SO4)2 中,溶质浓度由大到小的顺序为①>③>②>④。
(4)醋酸钠中醋酸根水解,溶液显碱性。氯化铵中铵根水解,溶液显酸性。盐酸是一元强酸,溶液显酸性。硝酸钠是强酸强碱盐,溶液显中性。A、B的水溶液中水的电离程度相同,二者是能水解的盐。A、C溶液的pH相同,则A是氯化铵,B是醋酸钠,C是盐酸,D是硝酸钠。
应用 | 原理解释 |
热的纯碱溶液去污能力强 | 加热促进了盐的水解,氢氧根离子浓度增大 |
泡沫灭火器原理 | Al3+与HCO |
明矾净水 | 铝离子水解生成的氢氧化铝胶体可用来净水 |
物质提纯 | 除去氯化镁酸性溶液中的氯化铁,可以加入氧化镁或氢氧化镁反应掉部分H+,促进铁离子的水解,使Fe3+转化为氢氧化铁沉淀而除去 |
配制易水解的盐溶液 | 配制FeCl3、FeCl2、SnCl2、AlCl3等溶液时,常将它们溶于较浓的盐酸中,然后再加水稀释;目的是抑制铁离子、亚铁离子、锡离子、铝离子的水解 |
草木灰不能与铵态氮肥混合施用 | 铵根离子与碳酸根离子相互促进水解,使生成的氨气逸出而降低了氮肥肥效 |
硫化铝、氮化镁的制备 | 硫化铝、氮化镁在水溶液中强烈水解,只能通过单质间化合反应才能制得 |
判断盐溶液蒸干产物 | FeCl3溶液蒸干并灼烧产物为Fe2O3 |
盐溶液除锈 | 氯化铵溶液除去金属表面的氧化物,因为NH4+ 水解显酸性,与氧化物反应 |


科目:高中化学 来源: 题型:
【题目】研究发现:一节电池烂在地里,能够使一平方米的土地失去利用价值。废旧电池的危害上要集中在其中所含的少量重金属上。将废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
(1)回收填料中的二氧化锰和氯化铵。已知:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。回收物质的流程如图所示。
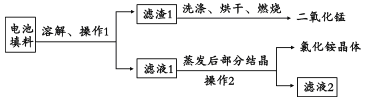
① 操作中先将电池填料研碎的目的是:________________。
② 操作l和操作2的名称都是___________,该操作中玻璃棒的作用是___________。
③ 灼烧滤渣l的目的是______________________。
(2)回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。
①写出MnOOH与浓盐酸反应的化学方程式:________________。
② 锰回收新方法:向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的化学方程式______________。与使用浓盐酸回收锰相比,新方法的优点是___________(答l点即可)。
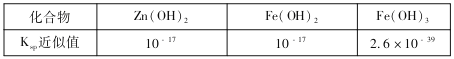
(3)用废电池的锌皮可用于回收制作ZnSO4·7H2O。过程中,需除去锌皮中的少量杂质铁,其方法是:常温下,加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=_________。继续加碱调节pH为____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。部分难溶的电解质溶度积常数(Ksp)如下表:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时纯水的电离度为a1,pH=2的醋酸溶液的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a1。下列关系式中正确的是
A.a2=a3<a4<a1 B.a3 = a2<a1<a4
C.a2<a3<a1<a4 D.a1<a2<a3<a4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
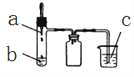
选项 | 实验试剂 | 实验现象 | 实验结论 | ||
a | b | c | |||
A | 浓氨水 | 碱石灰 | FeCl2溶液 | 产生白色沉淀,迅速变为灰绿色,最后变为红褐色 | 氨气具有氧化性 |
B | 稀硫酸 | FeS | AgCl悬浊液 | 悬浊液由白色变为黑色 | Ksp(AgCl)>Ksp(Ag2S) |
C | 浓硝酸 | 铜 | BaSO3悬浊液 | 悬浊液变澄清 | +4价硫具有还原性 |
D | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“保护环境”是我国的基本国策。下列做法不应该提倡的是
A. 生活垃圾分类收集 B. 垃圾进行露天焚烧
C. 宣传“低碳”出行 D. 合理使用化肥农药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃1 mol能和2 mol HCl加成得到饱和产物,其饱和产物又能和6 mol Cl2完全取代,则该烃是
A. C2H6 B. C2H2 C. C3H4 D. C4H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届广东省清远市清城区高三上期末】在HNO2溶液中存在如下平衡:HNO2H++NO2﹣,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是( )
A.NaOH溶液 B.硫酸溶液 C.NaNO2溶液 D.NaHSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有物质的量浓度相等的下列溶液:①醋酸、②盐酸、③苯酚钠、④苯酚、⑤碳酸钠、⑥碳酸氢钠、⑦硫酸、⑧氢氧化钠,按溶液pH由小到大排列正确的是
A.④①②⑦⑥③⑤⑧ B.④①②⑦⑤⑥③⑧
C.⑦①②④⑥③⑤⑧ D.⑦①④②③⑥⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某KNO3溶液中含杂质KCl和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是( )
A.AgNO3、K2CO3 B.AgNO3、K2CO3、HNO3
C.K2CO3、AgNO3 D.K2CO3、AgNO3、HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com