
【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
Ⅰ | 0.5molI2、0.5molH2 | w(HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
Ⅱ | xmolHI | w(HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=kaw(H2)w(I2),v逆=kbw2(HI),其中ka、kb为常数。下列说法不正确的是( )
A. 温度为T时,该反应![]() =64
=64
B. 容器I中在前20min的平均速率v(HI)=0.025molL-1min-1
C. 若起始时,向容器I中加入物质的量均为0.1mol的H2、I2、HI,反应逆向进行
. 无论x为何值,两容器中达平衡时w(HI)%均相同
【答案】C
【解析】
A. H2(g)+I2(g)2HI(g)
起始量(mol/L) 0.5 0.5 0
变化量(mol/L) n n 2n
平衡量(mol/L) 0.5-n 0.5-n 2n
w(HI)/%=![]() ×100%=80%,n=0.4 mol/L,平衡常数 K=
×100%=80%,n=0.4 mol/L,平衡常数 K=![]() =64。反应达到平衡状态时正逆反应速率相等,kaw(H2)w(I2)=v正=v逆=kbw2(HI),则
=64。反应达到平衡状态时正逆反应速率相等,kaw(H2)w(I2)=v正=v逆=kbw2(HI),则![]() =
=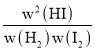 =K=64,故A正确;
=K=64,故A正确;
B.前20 min,H2(g) + I2(g)2HI(g)
起始量(mol/L) 0.5 0.5 0
变化量(mol/L) m m 2m
平衡量(mol/L) 0.5-m 0.5-m 2m
w(HI)%=![]() ×100%=50%,m=0.25mol/L,容器I中前20 min的平均速率,v(HI)=
×100%=50%,m=0.25mol/L,容器I中前20 min的平均速率,v(HI)=![]() =0.025molL-1min-1,故B正确;
=0.025molL-1min-1,故B正确;
C.若起始时,向容器I中加入物质的量均为0.l mol的H2、I2、HI,此时浓度商Qc=![]() =1<K=64,反应正向进行,故C错误;
=1<K=64,反应正向进行,故C错误;
D.H2(g)+I2(g)2HI(g)反应前后气体的物质的量不变,改变压强,平衡不移动,因此无论x为何值,Ⅰ和Ⅱ均等效,两容器达平衡时w(HI)%均相同,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】硫酸锰晶体(![]() )是重要的微量元素肥料之一。某兴趣小组在实验室中探究用软锰矿(主要成分为
)是重要的微量元素肥料之一。某兴趣小组在实验室中探究用软锰矿(主要成分为![]() ,含有少量
,含有少量![]() 、
、![]() 、
、![]() 等杂质制取硫酸锰晶体,其具体流程如下:
等杂质制取硫酸锰晶体,其具体流程如下:
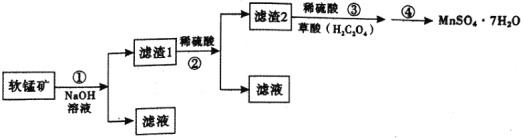
已知:①反应原理为:![]() ;
;
②![]() 难溶于水。
难溶于水。
(1)滤渣2主要成分是![]() ,步骤②中的稀硫酸的作用是________。
,步骤②中的稀硫酸的作用是________。
(2)步骤③中采用![]() 硫酸和草酸晶体溶解
硫酸和草酸晶体溶解![]() ,草酸晶体的作用是________;配制
,草酸晶体的作用是________;配制![]() 硫酸时,需要的仪器除量筒、烧杯、玻璃棒外,还需要________。将滤渣2置于烧杯中,先加入稀硫酸,将溶液稍加热后,在搅拌下缓慢分批加入草酸晶体,直至烧杯中的固体全部溶解。在搅拌下缓慢分批加入草酸晶体的理由是________。
硫酸时,需要的仪器除量筒、烧杯、玻璃棒外,还需要________。将滤渣2置于烧杯中,先加入稀硫酸,将溶液稍加热后,在搅拌下缓慢分批加入草酸晶体,直至烧杯中的固体全部溶解。在搅拌下缓慢分批加入草酸晶体的理由是________。
(3)步骤④的具体实验操作有________,经洗涤后干燥得到![]() 晶体。
晶体。
(4)兴趣小组同学拟继续研究硫酸锰的高温分解的固体产物,经查资料可知:硫酸锰晶体高温下分解产物为![]() 、
、![]() 、
、![]() ,及水蒸气。为了确定
,及水蒸气。为了确定![]() 的化学式,采用下面装置进行测定(已知:
的化学式,采用下面装置进行测定(已知:![]() 的熔点为16.8℃,沸点为44.8℃)。
的熔点为16.8℃,沸点为44.8℃)。
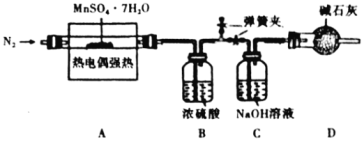
①![]() 装置中吸收的气体为________。
装置中吸收的气体为________。
②实验自始至终均需通入![]() ,其目的是________。
,其目的是________。
③若起始时,在装置A中加入![]() ,充分反应后,测得装置C增重6.4g,则
,充分反应后,测得装置C增重6.4g,则![]() 的化学式为________。
的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分连接装置省略)如图:
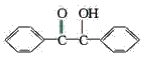 +2FeCl3
+2FeCl3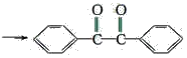 +2FeCl2+2HCl
+2FeCl2+2HCl
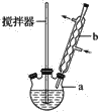
装置图中的两种玻璃仪器a为三颈烧瓶、b为球形冷凝管(或冷凝管),在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加热煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。
重结晶过程:加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
根据以上信息请回答下列问题:
(1)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体___。
A.缓慢冷却溶液
B.溶液浓度较高
C.溶质溶解度较小
D.缓慢蒸发溶剂
如果溶液中发生过饱和现象,可采用____等方法促进晶体析出。
(2)试推测抽滤所用的滤纸应略___(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是__。
A.无水乙醇
B.饱和NaCl溶液
C.70%乙醇水溶液
D.滤液
(3)上述重结晶过程中的哪一步操作除去了不溶性杂质___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.72g金属钠、氧化钠和过氧化钠的混合物与足量水反应,在标准状况下得到672mL混合气体,将混合气体电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比为( )
A. 3:2:1 B. 4:2:1 C. 2:1:1 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g) ![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g) ![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
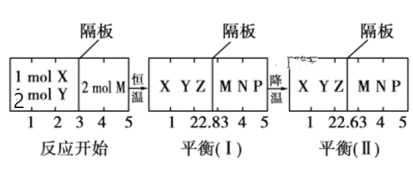
下列判断正确的是( )
A.反应①的正反应是吸热反应
B.达到平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为14:15
C.达到平衡(Ⅰ)时,X的转化率为5/11
D.在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若含有1 mol铁离子和1 mol铝离子的混合溶液,现按下图横坐标依次加入8 mol 氢氧化钠溶液、1 mol盐酸,通入1 mol 二氧化碳气体,纵坐标为混合沉淀的物质的量。

(1)请画出沉淀的量随反应的变化曲线______________。
(2)并写出加入氢氧化钠6 mol及其后发生的各步反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下平衡:2SO2(g)+O2(g)2SO3(g) △H= QkJ/mol(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述平衡的影响,下列分析正确的是

A. 图I研究的是t0时刻增大O2的浓度对平衡的影响
B. 图II研究的是t0时刻加入催化剂后对反应速率和平衡的影响
C. 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A.14gCO、N2混合气体中共含有7NA个电子
B.常温下,0.1mol环氧乙烷(![]() )共有0.3NA个共价键
)共有0.3NA个共价键
C.在含CO![]() 总数为NA的Na2CO3溶液中,Na+总数为2NA
总数为NA的Na2CO3溶液中,Na+总数为2NA
D.氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在无氧条件下,葡萄糖发生反应C6H12O6![]() 2CH3CH2OH + 2CO2↑。设NA是阿伏伽德罗常数的值。下列说法正确的是
2CH3CH2OH + 2CO2↑。设NA是阿伏伽德罗常数的值。下列说法正确的是
A.0.1 mol葡萄糖(C6H12O6)含羟基(-OH)数目为0.6NA
B.常温常压下,46 g CH3CH2OH与足量的钠反应产生氢分子数为0.5NA
C.4.48 L CO2和CO的混合气体所含碳原子总数为0.2NA
D.2.4 g Mg在足量的CO2中完全燃烧,转移电子数目为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com