
| A. | NaNO3 | B. | Mg(NO3)2 | ||
| C. | AgNO3 | D. | NaNO3和AgNO3的混合物 |
分析 涉及的反应方程式有:2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑、2NaNO3 $\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑、2Mg(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+4NO2↑+O2↑、2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑,根据分解方程式及题干气体体积变化进行解答.
解答 解:若完全为硝酸铜,分解方程式为:2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑,生成的二氧化氮和氧气的体积比为4:1,根据反应4NO2+O2+2H2O═4HNO3可知,用足量水吸收后不会剩余气体,所以硝酸铜含有的杂质在加热分解时生成的二氧化氮、氧气的体积比不会为4:1,
NaNO3、Mg(NO3)2、AgNO3三种硝酸盐热分解化学方程式如下:
2NaNO3 $\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑、2Mg(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+4NO2↑+O2↑、2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑,
由方程式可知,含有的杂质可以为NaNO3、AgNO3或其混合物,可不能为Mg(NO3)2,
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握二氧化氮与氧气、水反应的方程式,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 常温下所有的金属都是固态 | |
| B. | 金属具有导电、导热和延展性 | |
| C. | 金属元素的原子只有还原性,离子只有氧化性 | |
| D. | 所有金属元素都以化合态存在于自然界 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②④ | C. | ②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
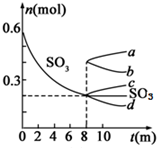 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,如图表示SO3物质的量随时间的变化曲线.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,如图表示SO3物质的量随时间的变化曲线.| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
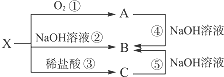 已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||||
| T | Q | W | G | |
| A. | 离子半径:T<W<G | |
| B. | 最简单气态氢化物的热稳定性:Q<R | |
| C. | 最高价氧化物对应水化物的酸性:Q>W>G | |
| D. | T和G组成的化合物甲溶于水,其水溶液呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com