
(8分)将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:
n(A)=n(B)=________mol;
(2)B的平均反应速率v(B)=________mol/(L·min);
(3)x的值为________。
(8分,每空2分)(1)0.75 3 (2)0.05 (3)2
解析试题分析:(1)5min后D的浓度为0.5 mol/L,所以D的物质的量是1mol,说明消耗B的物质的量是0.5mol,消耗A是1.5mol,设A、B的起始物质的量均是xmol,则此时A的物质的量x-1.5mol,B的物质的量是x-0.5mol,所以(x-1.5)/( x-0.5)=3:5,解得x=3,所以此时A的浓度c(A)=(3-1.5)mol/2L=0.75mol/L,n(A)=n(B)=3mol;
(2)B的浓度减少0.5mol/2L=0.25mol/L,所以B的平均反应速率v(B)=0.25mol/L/5min=0.05 mol/(L·min);
(3) C的平均反应速率为0.1 mol/(L·min),则C的浓度为0.1 mol/(L·min) ×5min=0.5mol/L,根据物质的浓度的改变量之比等于系数之比得x:2=0.5mol/L: 0.5 mol/L,所以x=2.
考点:考查化学反应速率、化学计量数的计算


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:单选题
硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发达水平的一种标志。目前主要生产方法是“接触法”,有关2SO2+O2 2SO3的说法中,不正确的是
2SO3的说法中,不正确的是
| A.该反应为可逆反应,故在一定条件下SO2和O2不可能全部转化为SO3 |
| B.达到平衡后,反应就停止了,故正、逆反应速率相等且均为零 |
| C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻之后,正、逆反应速率相等 |
| D.平衡时SO2、O2、SO3的分子数之比不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下,将两种气体M和N通入容积为V L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是 ( )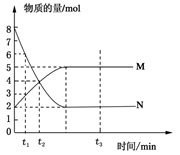
| A.t2时M与N的物质的量浓度之比为1:1 |
| B.t2与t3时刻的混合气体的平均相对分子质量相等 |
| C.反应物与生成物平衡时的物质的量浓度之比是2:5 |
D.0~t2内用M表示的平均反应速率是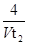 mol/(L?min) mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上利用某工厂的废渣(主要含CuO70%、MgFe2O420%,还含有少量FeO、NiO等氧化物)制取精铜和颜料铁红。流程如图所示。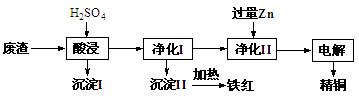
回答下列问题:
(1)净化Ⅰ操作分为两步:
第一步是将溶液中少量的Fe2+氧化;
第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下用H2O2氧化Fe2+反应的离子方程式: 。
②25 ℃时,pH=3的溶液中,c(Fe3+)=___________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ中第二步可选用CuO实现转化,用化学平衡移动原理说明其原因:
。
(2)用净化II所得的金属为电极进行电解得精铜,请写出阴极所发生的电极反应式:______________________________。
(3)为准确测定酸浸液中Fe2+的物质的量浓度以确定H2O2的用量,测定步骤如下:
①取出25.00mL酸浸液,配制成250.0mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.2000mol/LKMnO4溶液装入
(填仪器名称),进行滴定,记录数据,重复滴定3次,平均消耗KMnO4溶液V mL。(反应离子方程式:5Fe2++MnO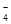 +10H+=5Fe3++Mn2++5H2O)
+10H+=5Fe3++Mn2++5H2O)
③计算酸浸液中Fe2+的物质的量浓度= mol/L (只列出算式,不做运算)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(7分)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(2分)某温度时,在2L固定体积的密闭容器中X、Y、Z三种气体随时间的变化如图所示: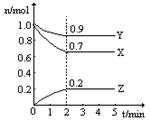
(1)该反应的化学方程式为 ;
(2)下列表示该反应速率最大的是
A.v(X)=0.6mol/(L·s) B.v(Y)=0.3mol/(L·s) C.v(Z)=0.5mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分) 在一定温度下,将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应,10分钟时达到平衡: 2SO2 + O2 2SO3 测得平衡时混合物总物质的量为5mol,求:
2SO3 测得平衡时混合物总物质的量为5mol,求:
(1)10分钟时O2的反应速率为 mol/(L·min)(2)平衡时SO2的转化率
(3) 平衡常数K为多少
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)(1)某温度时,在2 L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如下图所示。由图中数据分析,该反应的化学方程式为:____________________________
(2) 用Z表示从0—2min内该反应的平均反应速率为
____________________
(3) 某时刻t(t﹤5min)测得Y、Z两者的物质的量之比为
3:1,则X的转化率为_________
(4) 该条件下,能说明反应已达到平衡状态的是
a.容器内z物质的量浓度为0.25mol/L
b.正反应和逆反应的速率都为0
c.容器内X、Y、Z物质的量之比为1∶3∶2
d.容器内X气体的体积分数不变
e. 单位时间内消耗3a mol X,同时生成2a mol Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com