
| A. | 在用蒸馏水洗涤烧杯时,洗液未全部注入容量瓶中 | |
| B. | 用量筒量取浓硫酸时,俯视刻度线 | |
| C. | 用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理 | |
| D. | 定容时俯视刻度线 |
分析 结合c=$\frac{n}{V}$及不当操作对n、V的影响可知,n偏大或V偏小会导致所配溶液的物质的量浓度偏高,以此来解答.
解答 解:A.在用蒸馏水洗涤烧杯时,洗液未全部注入容量瓶中,可导致溶质偏少,则浓度偏低,故A错误;
B.用量筒量取浓硫酸时,俯视刻度线,导致实际量取的体积偏小,怎浓度偏小,故B错误;
C.容量瓶无需干燥,故C错误;
D.定容时俯视读取刻度,V偏小会导致所配溶液的物质的量浓度偏高,故D正确.
故选D.
点评 本题考查配制一定物质的量浓度的溶液,为高频考点,把握实验操作、浓度公式为解答的关键,侧重分析与应用能力的考查,注意不当操作对n、V的影响,题目难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
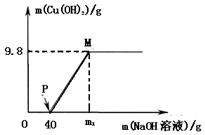 向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )
向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )| A. | 整个反应过程中,氯离子个数不变 | |
| B. | M点溶液中的溶质有一种 | |
| C. | P点溶液比M点溶液中氯化钠的质量分数大 | |
| D. | 沉沉完全时,m1的数值为120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2═Ca2++Cl2 | B. | H2SO4═2 H++SO42- | ||
| C. | Ba(OH)2═Ba++2OH- | D. | NaHCO3═Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26g | B. | 36g | C. | 104g | D. | 37.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+Br2 | B. | CH2=CH-CH2-CH3+HCl | ||
| C. | CH3-CH=CH2+H2O | D. | nCH2=CH-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
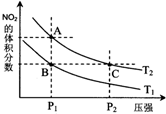 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| X | Y | ||
| Z | W | M |
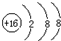 ;
; ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com