
【题目】在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置示意图如图.请回答:

①B电极的电极反应式是 .
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 .
【答案】①Cu2++2e﹣═Cu;
②镀层破损后,镀铜铁形成的原电池中铁作负极被腐蚀,镀锌铁形成的原电池中铁作正极被保护.
【解析】
试题分析:①在铁件的表面镀铜防止铁被腐蚀,由图可知,A为Cu,B为Fe,阳极上Cu失去电子,阴极上铜离子得到电子;
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,由原电池原理可知,负极失去电子被腐蚀.
解:①在铁件的表面镀铜防止铁被腐蚀,由图可知,A为Cu,B为Fe,则B电极的电极反应式是Cu2++2e﹣═Cu,
故答案为:Cu2++2e﹣═Cu;
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,原因为镀层破损后,镀铜铁形成的原电池中铁作负极被腐蚀,镀锌铁形成的原电池中铁作正极被保护,
故答案为:镀层破损后,镀铜铁形成的原电池中铁作负极被腐蚀,镀锌铁形成的原电池中铁作正极被保护.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R、N、T分别代表某种化学元素。请依据这9种元素回答下列问题。
A | |||||||||||||||||
D | F | ||||||||||||||||
G | Q | M | R | ||||||||||||||
N | |||||||||||||||||
(1)金属性最强的元素是 (填元素符号),写出表中所给元素中氧化物其氧化物具有两性的与同周期最高价氧化物对应水化物显碱性化合物之间的离子反应:_________
(2)元素的非金属性:M R(填“>”或“<”)。
(3)R的最高价氧化物对应水化物的化学式是 。
(4)F、G两元素形成的淡黄色固体物质的电子式为___________,该物质含有的化学键的类型是 ________ 。
(5)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是 (填离子符号)。
(6)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为 。
(7)A与D形成分子的空间结构可能是(填序号) 。
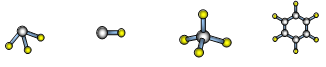
a b c d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,并回答下列问题:
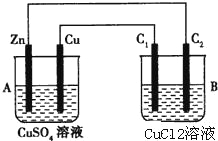
(1)判断装置的名称:A池为 ,B池为 .
(2)锌棒上发生 反应,电极反应式为 ;铜棒上的现象是 ,电极反应式为 ;石墨棒C1上发生的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是
A.80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4 NA
B.标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA
C.7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA
D.将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)乙酸是食醋的主要成分,它具有以下化学性质:
(1)可使紫色石蕊试液变_____色,说明乙酸具有__________性。
(2)能发生酯化反应.实验室用下图所示装置制取乙酸乙酯,
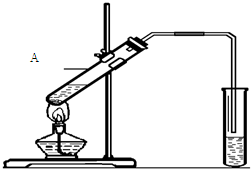
在试管A中加入的试剂有______(填写名称)、浓硫酸和冰醋酸,请写出该反应的化学方程式:______________________,浓硫酸在反应中起_________________(填一种即可)作用,生成的乙酸乙酯密度比水________(填“大”或“小”),并可以闻到有______________味。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由氯苯制取1,2,3,4﹣四氯己烷,步骤如下:
(1)写出A、B、C的结构简式A B .
(2)填写每步所属的反应类型(a.取代反应;b.加成反应;c.消去反应,只须填写字母):③ .
(3)反应②所需要的试剂和条件是
(4)反应④的化学方程式为④ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com