
【题目】某化学反应在所有温度下都能自发进行,下列对该反应的叙述正确的是( )
A.放热反应,熵增加 B.放热反应,熵减小
C.吸热反应,熵增加 D.吸热反应,熵减小
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)ΔH=akJ·mol-1
2Fe(s)+3CO2(g)ΔH=akJ·mol-1
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0kJ·mol-1
②C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5kJ·mol-1,则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为 。
②下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。

①在a~c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是用于气体的制备.干燥.性质实验、尾气处理的常用装置。请根据要求回答下列问题。

(1)怎样检查装置A的气密性 。
(2)某同学将仪器连接顺序为A-B-C-D,以此证明实验室制取Cl2的过程中有HCl和水蒸气挥发出来。
①A中反应的离子方程式是 。
②B中盛放的试剂是 ,C中盛放的是CCl4溶液,其作用是 ,D中盛放的试剂是 ,实验时看到的现象是 。
③有同学认为实验有缺陷,应该在C、D之间增加E装置,你认为该装置中.应放入 。
(3)最后,同学们用上述除B以外的仪器组装一套可以制出纯净干燥氯气的装置,按气流方向填出接口顺序a→ →ghf(不能选用B装置,其它装置可以重复使用;需要几个接口填几个).并按顺序写出所填接口对应仪器盛放的试剂 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】RFC是一种将水电解技术与氢氧燃料电池技术向结合的可充电电池。下图为RFC工作原理示意图,下列有关说法正确的是
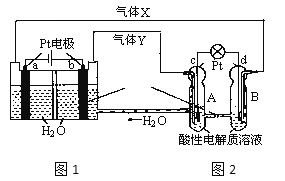
A.图1把化学能转化为电能,图2把电能转化为化学能,水得到了循环使用
B.当有0.1mol电子转移时,a极产生0.56LO2(标准状况下)
C.c极上发生的电极反应是:O2+4H++4e-=2H2O
D.图2中电子从c极流向d极,提供电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组拟用小颗粒状铝硅合金与足量稀硫酸的反应(已知硅与稀硫酸不反应),测定通常状况(20℃,101 kPa)下的气体摩尔体积。拟选用下列实验装置完成实验:

(1)该小组同学必须选用的装置依次连接的合理顺序为A、_____________。
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,开始时稀硫酸能滴人锥形瓶中,一段时间后稀硫酸不能顺利滴入锥形瓶中,其原因是____________________。
(3)金属铝与稀硫酸反应的离子方程式为_________________。
(4)实验结束时,测量实验中生成H2体积的操作方法是_______________。
(5)实验中准确测得3个数据:实验前铝硅合金的质量m1g,实验后残留固体的质量m2g,实验后量筒中液面读数为V ml。。则通常状况下气体摩尔体积Vm=__________L·mol-l。若合金中含少量铜,则所测得的Vm将____________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2、CO、CH4的燃烧热分别为ΔH1=-285.8 kJ/mol、ΔH2=-283 kJ/mol、ΔH3=-890 kJ/mol。H2O(g)=H2O(l) ΔH4=-44 kJ/mol。回答下列问题:
(1)用CH4替代水煤气作家用燃气的优点是____________________。将煤气灶改为天然气灶时,应适当调_________(填“大”或“小”)空气进气阀门。
(2)合成氨厂一般采用烃(以CH4为例)和水蒸气反应制取原料气H2,发生如下反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
①该反应的ΔH=________________。
②当该反应达到平衡状态时,下列说法一定正确的是__________(填字母)。
A.v(CH4)=v(CO) B.加入催化剂,ΔH不变
C.升高温度,平衡常数K增大 D.CH4与H2O的转化率相等
③T℃时,该反应的初始浓度与起始速率的部分数据如下:
初始浓度/mol·L-1 | 起始速率/mol3·L-3·s-1 | |
c(CH4) | c(H2O) | v |
0.10 | 0.10 | 1.0×10-4 |
0.10 | 0.20 | 4.0×10-4 |
0.30 | 0.20 | 1.2×10-3 |
写出起始速率与初始浓度的关系式[用c(CH4)、c(H2O)及适当的速率常数表示]v=________。
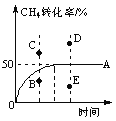
④T℃时,在一个体积可变的恒压密闭容器中,充入0.1 mol CH4、0.1 mol H2O(g)发生反应,起始时容器的体积为1 L。CH4的转化率与反应时间的关系如图中曲线A所示。则T℃时该反应的平衡常数K=____________。若温度与投料方式相同,该反应在容积为1 L的恒容密闭容器中进行,刚达平衡状态的点是__________(选填B、C、D、E)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成。甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子。A元素原子核内质子数比E的少l,D、E同主族。某同学为探究甲的组成而进行如下实验:

①取mg甲的晶体溶于蒸馏水,配成500 mL溶液;
②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀的物质的量与滴入Ba(OH)2溶液体积的关系如图所示;
③取20 mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,然后折算成标准状况下的体积为224 mL。
回答下列问题:
(1)D在元素周期表中的位置为_ 。
(2)经测定晶体甲的摩尔质量为453 g·mol-1,其中阳离子和阴离子物质的量之比为1:1。 则晶体甲的化学式为 。
(3)图像中V(Oa):V(ab):V(bc)= 。
(4)写出ab段发生反应的离子方程式: 。
(5)配成的甲溶液物质的量浓度是_ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 用肼(N2H4)还原新制Cu(OH)2 |
方法Ⅲ | 电解法:2Cu+H2O |
已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H=-akJ·mol-1
C(s)+1/2O2(g)=CO(g);△H=-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s);△H=-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g) △H = kJ·mol-1
(1)工业上很少用方法Ⅰ制取Cu2O是由于方法Ⅰ反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因: 。
(2)方法Ⅱ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式:阴极 ;阳极 。

(4)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:2H2O(g) ![]() 2H2(g)+ O2(g) ⊿H >0,水蒸气的浓度(mol·L-1)随时间t (min)变化如下表所示:
2H2(g)+ O2(g) ⊿H >0,水蒸气的浓度(mol·L-1)随时间t (min)变化如下表所示:
序号 | Cu2Oa克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法Ⅱ | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 方法Ⅱ | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | 方法Ⅲ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母代号)。
a.实验的温度T2小于T1
b.实验①前20 min的平均反应速率v(O2)=7×10-5 mol·L-1 min-1
c.实验②比实验①所用的催化剂催化效率高
d.实验①、②、③的化学平衡常数的关系:K1=K2<K3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家开发出一种新型锂—氧电池,其能量密度极高,效率达90%以上。电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:
O2+4LiI+2H2O2I2+4LiOH

对于该电池的下列说法不正确的是( )
A.放电时负极上I- 被氧化
B.充电时Li+从阳极区移向阴极区
C.充电时阴极反应为LiOH+e-==Li+OH-
D.放电时正极反应为O2+2H2O+4Li++4e-==4LiOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com