
在密闭容中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A.A的转化率变大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a < c+d
科目:高中化学 来源: 题型:
聚合硫酸铁又称聚铁,化学式为 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:

(1)验证固体W焙烧后产生的气体含有SO2 的方法是_____。
(2)实验室制备、收集干燥的SO2 ,所需仪器如下。装置A产生SO2 ,按气流方向连接各仪器接口,顺序为a f装置D的作用是_____,装置E中NaOH溶液的作用是______。

(3)制备绿矾时,向溶液X中加入过量_____,充分反应后,经_______操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为______。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列三种有机物是某些药物中的有效成分。


下列说法正确的是( )
A.三种有机物都能发生水解反应 B.使用FeCl3溶液和稀硫酸可以鉴别这三种有机物
C.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
D.将等物质的量的三种物质加入氢氧化钠溶液中,对羟基桂皮酸消耗氢氧化钠最多
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将pH=3的盐酸和10-3 mol·L-1的氨水等体积混和后,溶液中离子浓度关系正确的是( )
A.[NH4+]>[Cl-]>[H+]>[OH-] B.[NH4+]>[Cl-]>[OH-]>[H+]
C.[Cl-]>[NH4+]>[H+]>[OH-] D.[Cl-]>[NH4+]>[OH-]> [H+]
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.往氯水中加入少量水会增强溶液的酸性
B.常温下,pH=1的水溶液中Na+、NO3-、HCO3-、Fe2+可以大量共存
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
D.C(石墨,s)=C(金刚石,s), ΔH>0,所以石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
“嫦娥一号”的登月成功,实现了中国人“奔月”的梦想。
⑴ 2H2(g)+O2(g)=2H2O(l); H=-571.6kJ·mol-1
H=-571.6kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(l); H=-5518 kJ·mol-1
H=-5518 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)  H =-890kJ·mol-1
H =-890kJ·mol-1
相同质量的H2 、C、 C8H18 、CH4完全燃烧时,放出热量最多的是 。
⑵ 氢气、氧气不仅燃烧能放出热量,二者形成的原电池还能提供电能。“嫦娥一号”绕月飞行部分使用的是氢氧燃料电池,电解质溶液为KOH溶液,其电极反应式为:
负极 ;正极 ;
⑶若用氢氧燃料电池电解100mL由NaCl 和CuSO4组成的混合溶液,其中
[Na+]=3[Cu2+]=0.3mol·L-1,用石墨作电极,通电一段时间后,在阴极收集到0.112L H2(标况).
试计算:
①阴极析出Cu mol。阳极析出气体为 (填化学式)。
②若所得溶液仍然为100mL,则此时溶液的pH值为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏加德罗常数的数值为NA,下列说法正确的是
A.80mL 10mol 浓盐酸与足量MnO2反应,转移电子数为0.4NA
浓盐酸与足量MnO2反应,转移电子数为0.4NA
B.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA
C.1 mol A13+含有核外电子数为3NA
D.常温下,16g CH4中共用电子对的数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
以电石渣(主要成分是Ca(OH)2,含SiO2以及其它少量杂质)为原料生产氯酸钾联合生产碳酸钙的流程如下:

回答下列问题:
32、电石渣溶于水形成电石渣浆时发生的主要反应的化学方程式为:
33、氯化过程的温度控制在75~80℃,该过程主要反应的离子方程式为: _______________________________________________________________
34、该流程中加入活性炭的作用是
35、碳化过程中,先向溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。

如果按气流方向连接各仪器接口,你认为正确的顺序为a→ 、 → 、 →i。其中与i相连漏斗的作用是 。
②实验室中还可用固体氢氧化钠和浓氨水制取少量氨气,下列最适合完成该实验的简易装置是 (填编号)

36、副产品A的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲酸甲酯水解反应方程式为:
 ≒
≒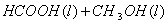

某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:

甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:

请计算15-20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率
为 mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因: 。
(3)上述反应的平衡常数表达式为: ,则该反应在温度
,则该反应在温度
T1下的K值为 。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com