
�ش��������⣺
(1)�л���A�ķ���ʽ��________________��
(2)A�����Ʒ�Ӧ��Ҳ����̼�����Ʒ�Ӧ��A�к��еĹ����ŵ�������________________��
(3)A��Ũ���Ṳ�ȿ�����һ�������ԭ�ӹ��ɵĻ�״������B��д����ѧ����ʽ��________________________________��
(4)A��Ũ���Ṳ�Ȼ���������һ����ʹBr2�����Ȼ�̼��Һ��ɫ�Ļ�����C��д��A����C�Ļ�ѧ����ʽ��________________________________����Ӧ������________________��
����C���Ժϳɸ߷��ӻ�����D��D�Ľṹ��ʽ��________________��
(5)A��һ��ͬ���칹��E�����ⶨ���ӽṹ�к���һ����CH3������![]() ������������Һ��Ӧ������������д��E��Ag(NH3)2OH��Һ��Ӧ�Ļ�ѧ����ʽ��________________��
������������Һ��Ӧ������������д��E��Ag(NH3)2OH��Һ��Ӧ�Ļ�ѧ����ʽ��________________��
������0.1 mol Aȼ������![]() =3����A�ķ���ʽΪC4H8O3��A����̼�����Ʒ�Ӧ��˵��A�к���COOH��A��Ũ�������ʱ���ȿ��γɻ���B��˵��A�л����С�OH��Ũ�������ʱ����A��Ҳ�ܷ�����ȥ��Ӧ����ϩ��������ʣ������ʿɷ����Ӿ۷�Ӧ���ɸ߷��ӻ����E�ܷ���������Ӧ��˵������CHO��E���ֺ�һ����CH3����E�ĽṹʽΪ
=3����A�ķ���ʽΪC4H8O3��A����̼�����Ʒ�Ӧ��˵��A�к���COOH��A��Ũ�������ʱ���ȿ��γɻ���B��˵��A�л����С�OH��Ũ�������ʱ����A��Ҳ�ܷ�����ȥ��Ӧ����ϩ��������ʣ������ʿɷ����Ӿ۷�Ӧ���ɸ߷��ӻ����E�ܷ���������Ӧ��˵������CHO��E���ֺ�һ����CH3����E�ĽṹʽΪ![]() ��
��
�𰸣�
(1)C4H8O3
(2)�ǻ����Ȼ�
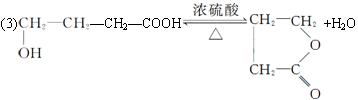
(4) ��ȥ��Ӧ
��ȥ��Ӧ![]()
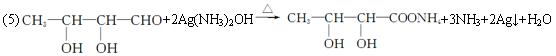


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| Ũ���� |
| �� |
| Cu |
| �� |
| Ũ���� |
| �� |
| Cu |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com