
| A. | 10% | B. | 大于10% | C. | 小于10% | D. | 无法确定 |
科目:高中化学 来源: 题型:解答题
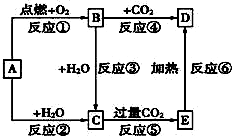 如图中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.已知A在空气中燃烧生成淡黄色固体(部分产物已略去).
如图中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.已知A在空气中燃烧生成淡黄色固体(部分产物已略去). 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中,加入1.5mol H2和0.5mol N 2充分反应后,可得到NH3分子数为NA | |
| B. | 常温下,pH=2的醋酸溶液中所含H+的数目为0.01NA | |
| C. | 1L 0.1mol•L-1 AlCl3的溶液中所含Al3+的数目为0.1NA | |
| D. | 精炼铜时,阴极质量增加6.4g,则电路中转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加催化剂,v(正)和v(逆)都发生变化,且变化的倍数相等 | |
| B. | 加压,v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数 | |
| C. | 降温,v(正)和v(逆)都减少,且v(正)减少倍数大于v(逆)减少倍数 | |
| D. | 增加c(N2),v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于分离C2H5OH和H2O的混合物 | |
| B. | 装置②可用于收集H2、Cl2等气体 | |
| C. | 装置③可用于有关NH3实验的尾气处理 | |
| D. | 装置④可用于洗涤BaSO4淀表面吸附的少量氯化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液中滴加入Ba(OH)2溶液至中性H++Ba2++OH-+SO42-═BaSO4↓+H2O | |
| B. | 酸性KMnO4溶液与双氧水反应:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 钢铁腐蚀时可能发生的正极反应为:4OH-+4e-═2H2O+O2↑ | |
| D. | 将氯气溶于水制备次氯酸:Cl2+H2O?2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中转移电子为0.04 mol | B. | Q中n(Cu2+):n(Fe2+)=1:2 | ||
| C. | 溶液Q比原溶液增重了 1.28 g | D. | 3c(Fe3+)+2c(Fe2+)+2c(Cu2+)=0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 固体质量 | 加入某浓度盐酸的体积/mL | 加入某浓度NaOH的体积/mL | 收集到气体体积/mL |
| 1 | 0.9 | 20.0 | ─ | 1008 |
| 2 | 0.9 | 30.0 | ─ | 1008 |
| 3 | 0.9 | ─ | 20.0 | 672 |
| 4 | 0.9 | ─ | 30.0 | 672 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com