

| A. | 装置①可用于实验室制取乙酸乙酯 | |
| B. | 装置②可用于分离苯和硝基苯的混合物 | |
| C. | 装置③可用于以苯为原料萃取碘水中的碘 | |
| D. | 装置④可用于实验室制取乙烯 |
分析 A.制取乙酸乙酯时用饱和碳酸钠溶液且导气管不能伸入液面下;
B.蒸馏时,温度计水银球位于蒸馏烧瓶支管口处;
C.碘易溶于苯;
D.缺少温度计.
解答 解:A.制取乙酸乙酯时用饱和碳酸钠溶液且导气管不能伸入液面下,否则会产生倒吸现象,故A错误;
B.蒸馏时,温度计水银球位于蒸馏烧瓶支管口处,不能插入液面下,故B错误;
C.碘易溶于苯,苯和水不溶,可做萃取剂,故C正确;
D.反应需加热到170℃,缺少温度计,故D错误.
故选C.
点评 本题考查了实验方案评价,涉及物质的制取、分离提纯等知识点,明确物质的性质是解本题关键,同时考查学生思考问题的缜密性,知道A中饱和碳酸钠溶液的作用,为易错点.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:填空题
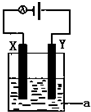 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:填空题
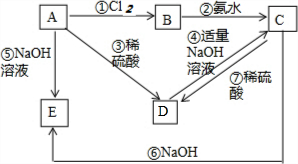 已知金属A为常见的金属单质,根据下列物质的转化关系完成各小题(图中表示主要物质的转化关系,反应中生成的水、气体等物质未标出)
已知金属A为常见的金属单质,根据下列物质的转化关系完成各小题(图中表示主要物质的转化关系,反应中生成的水、气体等物质未标出)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液:S2-、NO3-、Cl-、Na+ | |
| C. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| D. | 由水电离出来的c(H+)=10-10mol•L-1的溶液:Na+、SO42-、S2-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,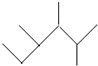 的名称为2,3-二甲基-4-乙基庚烷 的名称为2,3-二甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 石油裂解可以得到乙烯,煤液化可得到煤焦油、粗氨水、粗苯等液体 | |
| D. | 1molHC≡CCHO最多能与3mol H2完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH在水中电离:CH3COOH═H++CH3COO- | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+H+═HCO3ˉ | |
| C. | 大理石中加入稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | MgC12溶液与过量氨水反应:Mg2++2OH-═Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com