
分析 (1)铅蓄电池放电时正极发生还原反应,电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O;
(2)惰性电极电解CuSO4溶液,阳极产生氧气,阴极生成铜,离子方程式为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+;
(3)碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳,所以加入1mol 碱式碳酸铜[Cu2(OH)2CO3]相当于加入2molCuO、1molH2O,根据生成物知,阴极上铜离子和氢离子放电、阳极上氢氧根离子放电,根据铜和氢气的物质的量与转移电子之间的关系式计算转移电子的物质的量,
解答 解:(1)铅蓄电池放电时正极发生还原反应,电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O,故答案为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;
(2)惰性电极电解CuSO4溶液,阳极产生氧气,阴极生成铜,离子方程式为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,故答案为:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+;
(3)碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳,所以加入0.1mol碱式碳酸铜[Cu2(OH)2CO3]相当于加入2molCuO、1molH2O,根据生成物知,阴极上铜离子和氢离子放电、阳极上氢氧根离子放电,根据Cu原子、H原子守恒得阴极上析出n(Cu)=2mol、n(H2)=1mol,则转移电子的物质的量=2mol×2+1mol×2=6mol,该电解过程中铅蓄电池中消耗的H2SO4为12mol,而电解池中生成的H2SO4的物质的量为6mol,故答案为:6NA,2:1.
点评 本题考查了电解原理,根据离子放电顺序、原子守恒来分析解答,明确加入物质的性质是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA | |
| B. | 标准状况下,2.24 L Cl2与氢氧化钠溶液完全反应转移电子数为0.1NA | |
| C. | 1 mol NaCl中含有6.02×1023个NaCl分子 | |
| D. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 解释或结论 |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,溶液褪色 | SO2具有漂白性 |
| B | 将NaHCO3和NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| C | 某钾盐溶于盐酸,产生无色无味气体,该气体通入 澄清石灰水,有白色沉淀出现 | 该钾盐是K2CO3 |
| D | NaI溶液$\stackrel{30%H_{2}O_{2}溶液}{→}$$\stackrel{稀硝酸及淀粉}{→}$溶液变蓝色 | 酸性条件下H2O2的氧化性比I2强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
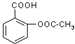 试根据阿斯匹林的结构回答;
试根据阿斯匹林的结构回答; ,其分子式为C7H6O3,则B的结构简式为CH3COOH;
,其分子式为C7H6O3,则B的结构简式为CH3COOH;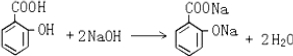 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 CuI是一种不溶于水的白色固体,它可以由反应2Cu2++4I-═2CuI↓+I2而得到.如图所示装置中,a、b都是惰性电极,通电一段时间后,在KI淀粉溶液中阳极周围变蓝色,则下列说法正确的是( )
CuI是一种不溶于水的白色固体,它可以由反应2Cu2++4I-═2CuI↓+I2而得到.如图所示装置中,a、b都是惰性电极,通电一段时间后,在KI淀粉溶液中阳极周围变蓝色,则下列说法正确的是( )| A. | 若b极变红,则在Cu极上:Cu-2e-═Cu2+,Cu2+显蓝色 | |
| B. | 若a极变红,则在Pt电极上:2I--2e-═I2,淀粉遇碘变蓝 | |
| C. | 若a极变红,则在Cu电极上:开始Cu+I--e-═CuI,一段时间后2I--2e-═I2,淀粉遇碘变蓝 | |
| D. | 若b极变红,则在Pt电极上:4OH--4e-═2H2O+O2↑,O2将I-氧化为I2,淀粉遇碘变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com