
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的内层电子总数是最外层电子数的5倍。下列说法中不正确的是
A.W、M的某种单质可作为水处理中的消毒剂
B.电解YW2的熔融物可制得Y和W的单质
C.相同条件下,W的氢化物水溶液酸性比Z弱
D.X、M两种元素形成的一种化合物与水反应可生成M的某种单质
科目:高中化学 来源:2014高考名师推荐化学化学平衡常数(解析版) 题型:选择题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
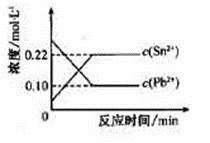
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学实验的基本操作(解析版) 题型:选择题
对于实验Ⅰ~Ⅳ的实验现象预测正确的是

A.实验Ⅰ:逐滴滴加盐酸时,试管中立即产生大量气泡
B.实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色
C.实验Ⅲ:从饱和食盐水中提取NaCl晶体
D.装置Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅直至褪去
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学制备实验方案的设计与评价(解析版) 题型:实验题
下列实验方案正确且能达到相应实验预期目的的是
|
|
|
|
A.制取少量蒸馏水 | B.制取少量NO2 | C.比较MnO2、Cl2、I2的氧化性 | D.探究NH4HCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学元素周期表及其应用(解析版) 题型:选择题
四种短周期元素在周期表中的位置如右图,其中只有M为金属元素。下列说法不正确的是
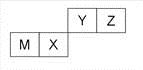
A.原子半径Z<M
B.Y的最离价氧化物对应水化物的酸性比X 的弱
C.X 的最简单气态氢化物的热稳定性比Z的小
D.Z位于元索周期表中第2 周期、第ⅥA族
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学元素周期律及化学键(解析版) 题型:选择题
下列关于原子结构、元素性质的说法正确的是
A.非金属元素组成的化合物中只含共价键
B.IA族金属元素是同周期中金属性最强的元素
C.同种元素的原子均有相同的质子数和中子数
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学元素周期律及化学键(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y原子最外层只有2个,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
A 元素X的简单气态氢化物的热稳定性比W弱
B 元素W的最高价氧化物对应水化物的酸性逐渐比Z弱
C 化合物YX、ZX2、WX3中化学键类型相同
D 原子半径的大小顺序:rY>rZ>rW>rX
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学乙醇和乙酸(解析版) 题型:选择题
下列说法正确的是

A.实验室常用如上图所示的装置制取少量的乙酸乙酯
B.可用点燃的方法鉴别甲烷和乙烯
C.糖类、蛋白质、油脂属于天然有机高分子化合物
D.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Ksp的计算及有关图像的分析(解析版) 题型:填空题
(1)①25 ℃时,将20 mL 0.1 mol·L-1CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示。反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。

反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”“<”或“=”)。
②若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)。
A.c(CH3COO-) B.c(H+) C.KW D.醋酸电离平衡常数
E.
(2)下图为某温度下,PbS(s).ZnS(s).FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度.金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+.Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。

(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10 mL 0.01 mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ,c(H2C2O4) c(C2 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com