


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:

| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:

| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃省天水市秦安县高三上学期期末检测化学试卷(解析版) 题型:选择题
分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是
|
“嫦娥一号” 发射火箭燃料 |
液氢(H2) |
①2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1 ②2H2(l)+O2(l)=2H2O(g) △H=-482.6kJ·mol-1 |
|
北京奥运会“祥云” 火炬燃料 |
丙烷(C3H8) |
③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=-2013.8kJ·mol-1 ④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ·mol-1 |
A.571.6 kJ·mol-1,2221.5kJ·mol-1 B.241.3 kJ·mol-1,2013.8 kJ·mol-1
C.285.8 kJ·mol-1,2013.8 kJ·mol-1 D.285.8 kJ·mol-1,2221.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市六校高三第三次联考理综化学试卷(解析版) 题型:填空题
2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)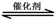 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应平衡常数表达式
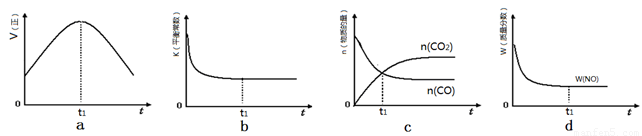
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g)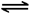 N2O4(g)
△H=-56.9 kJ/mol
N2O4(g)
△H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
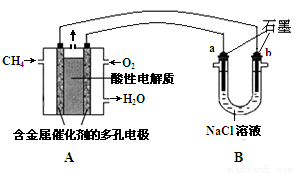
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
①甲烷燃料电池的负极反应式: 。
②电解后溶液的pH= (忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是 L
查看答案和解析>>
科目:高中化学 来源:2011-2012年福建省福州市高二上学期第一次月考化学试卷 题型:选择题
分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是( )
|
“嫦娥一号”发射火箭燃料 |
液氢 (H2) |
①2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1 ②2H2(l)+O2(l)=2H2O(g) △H=-482.6kJ·mol-1 |
|
北京奥运会“祥云”火炬燃料 |
丙烷 (C3H8) |
③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=-2013.8kJ·mol-1 ④ C3H8(g)+5O2(g) =3CO2(g)+4H2O(l)△H=-2221.5kJ·mol-1 |
A、571.6 kJ·mol-1,2221.5kJ·mol-1 B、241.3 kJ·mol-1,2013.8 kJ·mol-1
C、285.8 kJ·mol-1,2013.8 kJ·mol-1 D、285.8 kJ·mol-1,2221.5 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com