
(1)已知:
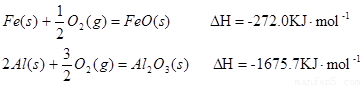
Al和FeO发生铝热反应的热化学方程式是 。(3分)
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。

①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选填序号)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:
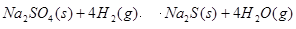 该反应的平衡常数表达式为 。
该反应的平衡常数表达式为 。
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”)。
(15分) (1)3FeO(s)+2Al(s)﹦Al2O3(s)+3Fe(s) △H=-859.7KJ/mol(3分)
(2) ①吸 增大 ② D (3) K= c4(H2O)/c4(H2) (4) ①107 ②>
【解析】
试题分析:(1)根据盖斯定律可知②-①×3即得到3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s),所以该反应的反应热△H=-1675.7KJ/mol+272 KJ/mol×3=-859.7KJ/mol。
(2)①据图可判断反应物的总能量低于生成物的总能量,所以该反应是吸热反应。所以升高温度平衡向正反应方向移动,反应物的转化率增大。
②根据图像可知,B历程中活化能降低,所以改变的条件是使用了催化剂,答案选D。
(3)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,K=c4(H2O)/c4(H2)。
(4)①取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,这说明生成物NaA水解,促进水的电离,所以混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为10-6:10-13=07。
②NH4A溶液为中性,说明氨水的电离程度与HA的电离程度相等。又因为将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性强于碳酸的酸性,所以(NH4)2CO3溶液中CO32-的水解程度大于NH4+的水解程度,则溶液的pH大于7。
考点:考查盖斯定律的应用、外界条件对平衡状态的影响、平衡常数的判断、水的电离平衡以及盐类水解
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难易适中,贴近高考。该题在注重对基础性知识考查与训练的同时,侧重对学生能力的培养与解题方法的指导与训练,有助于培养学生的逻辑推理能力,提高学生的应试能力与学习效率。


科目:高中化学 来源: 题型:
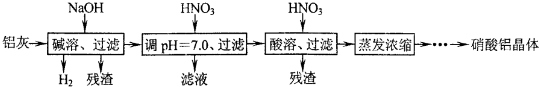
| Al(OH)3 | 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 |
| pH | 3.3 | 5.0 | 7.8 | 12.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
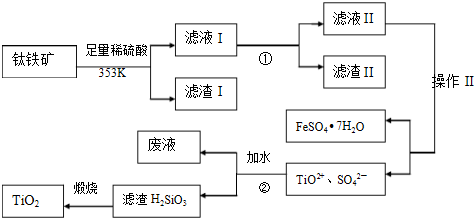
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖南益阳箴言中学高二下学期期末考试理科化学试卷(带解析) 题型:填空题
(1)已知: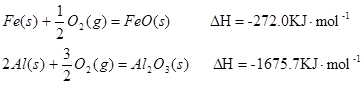
Al和FeO发生铝热反应的热化学方程式是 。(3分)
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。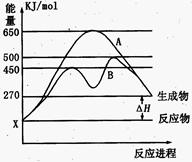
①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选填序号)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应: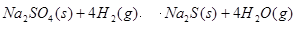 该反应的平衡常数表达式为 。
该反应的平衡常数表达式为 。
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义。
请回答下列问题:
(1)已知:

Al和FeO发生铝热反应的热化学方程式是 。
 (2)硫酸生产中涉及反应:2SO
(2)硫酸生产中涉及反应:2SO![]() (g)+O
(g)+O![]() (g)
(g)![]() 2SO
2SO![]() (g)。
(g)。
① 一定条件下,SO![]() 的平衡转化率和温度的关系如右图所示。该反应的ΔH O(填“>”或“<”)。反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
的平衡转化率和温度的关系如右图所示。该反应的ΔH O(填“>”或“<”)。反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
②下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
A.容器内压强不再发生变化 B.SO![]() 的体积分数不再发生变化
的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
③以下操作将引起平衡向正反应方向移动并能提高SO![]() 转化率的是
转化率的是
A.向容器中通入少量O![]() B.向容器中通入少量SO
B.向容器中通入少量SO![]()
C.使用催化剂 D.升高温度 E.恒容通入少量氦气
④气体SO2是大气污染物,可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com