
| 甲的球棍模型 | 乙的结构式 | 丙的球棍模型 | 丁的比例模型 |
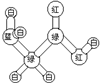 | 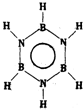 | 丙的分子式为C13H10O3 | 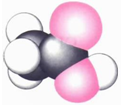 |
| A. | 甲可代表氨基酸 | B. | 乙的二氯代物有3种 | ||
| C. | 丙的结构简式为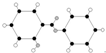 | D. | 丁可代表乙酸 |
分析 A.碳原子形成四个共价键,氮原子形成三个共价键,氧原子形成两个共价键,氢原子形成一个共价键,球棍模型中“棍”代表单键或双键或三键;
B.固定一个氯原子,有两种,然后加入另一个氯原子分析判断存在的同分异构体;
C.结合碳原子形成四个共价键,氧原子形成两个共价键,氢原子形成一个共价键,球棍模型中黑色为碳原子,暗色球为氧原子,白色球为氢原子;
D.比例模型中黑球为碳原子,红球为氧原子,白球为氢原子,据此写出结构简式判断;
解答 解:A.球棍模型中球的颜色不同属于不同原子,“棍”代表单键或双键或三键,可以表示氨基乙酸,CH2(NH2)-COOH,可以代表氨基酸,故A正确;
B.固定一个氯原子,有两种,然后加入另一个氯原子,邻、间、对三种同分异构体,改变第一个氯原子位置,则间位连接另一个氯原子形成一种同分异构体,有四种,故B错误;
C.结合碳原子形成四个共价键,氧原子形成两个共价键,氢原子形成一个共价键,球棍模型中黑色为碳原子,暗色球为氧原子,白色球为氢原子,计算得到分子式为:C13H10O3,故C正确;
D. 比例模型中黑球为碳原子,红球为氧原子,白球为氢原子,可以表示乙酸的比例模型,故D正确;
比例模型中黑球为碳原子,红球为氧原子,白球为氢原子,可以表示乙酸的比例模型,故D正确;
故选B.
点评 本题考查了有机物的结构简式、球棍模型、比例模型等表示方法,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 苯是一种石油化工基本原料,也是最简单的芳烃.苯分子中的一个氢原子分别被甲基、羟基、氨基取代生成的化合物是甲苯、苯酚和苯胺.
苯是一种石油化工基本原料,也是最简单的芳烃.苯分子中的一个氢原子分别被甲基、羟基、氨基取代生成的化合物是甲苯、苯酚和苯胺.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠(固体) | B. | 水 | C. | 稀盐酸 | D. | 硫酸铵(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z2与X-在水溶液中不能大量共存 | |
| B. | 还原性:Y->Z->W- | |
| C. | 2NaW+Y2=2NaY+W2 | |
| D. | W2通入到NaX和NaY的混合溶液中:W2优先氧化Y- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
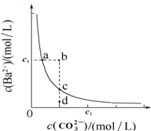
| A. | 通过蒸发可以使溶液由d点变到c点 | |
| B. | b点有BaCO3沉淀生成 | |
| C. | 升高温度,可以使d点变为c点 | |
| D. | 在a点加入Na2CO3,达平衡时c(Ba2+)≠c(CO32-),其Ksp大于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
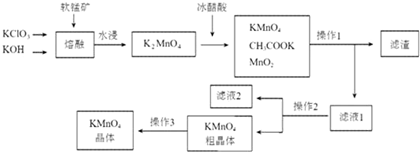
| 物质 温度 | KMnO4 | CH3COOK | K2SO4 | KCl |
| 20℃ | 6.34 | 217 | 11.1 | 34.2 |
| 90℃ | 45.2 | 398 | 22.9 | 53.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ①的气态氢化物的电子式
①的气态氢化物的电子式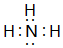 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com