
| A. | 乙酸溶液的导电性比盐酸溶液的弱 | |
| B. | 0.1mol/L乙酸钠溶液的pH约为8 | |
| C. | 把0.1mol/L乙酸溶液温度升高10℃后(不考虑水蒸发),其 pH降低 | |
| D. | 等浓度等体积的乙酸和盐酸在开始与同样大小的镁反应时,盐酸反应快 |
分析 A.导电性强弱和离子浓度大小有关,与电解质强弱无直接关系;
B.0.1mol/L乙酸钠溶液的pH约为8,溶液显碱性证明乙酸钠为强碱弱酸盐,溶液中乙酸根离子水解;
C.把0.1mol/L乙酸溶液温度升高10℃后,溶液PH降低,说明溶液中存在电离平衡,升温促进电离氢离子浓度增大;
D.等浓度等体积的乙酸和盐酸在开始与同样大小的镁反应时,盐酸反应盐酸反应快,说明乙酸溶液中氢离子浓度小;
解答 解:A.导电性强弱和离子浓度大小有关,乙酸溶液的导电性比盐酸溶液的只能说明乙酸溶液中离子浓度小,但乙酸溶质浓度和氯化氢浓度不知,不能判断乙酸溶液中存在电离平衡,故A错误;
B.0.1mol/L乙酸钠溶液的pH约为8,溶液显碱性,溶液中乙酸根离子存在水解平衡,证明乙酸为弱酸电解质属于,故B正确;
C.升温促进电离,把0.1mol/L乙酸溶液温度升高10℃后,溶液PH降低,说明溶液中存在电离平衡,氢离子浓度增大溶液中存在电离平衡属于弱电解质,故C正确;
D.等浓度等体积的乙酸和盐酸在开始与同样大小的镁反应时,盐酸反应盐酸反应快,说明开始乙酸溶液中氢离子浓度小存在电离平衡属于弱电解质,故D正确;
故选A.
点评 本题考查了弱酸的电离平衡及其应用,题目难度不大,注意掌握弱电解质的概念及判断方法,明确弱电解质的电离平衡及其影响因素,试题有利于培养学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
类别 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 生理盐水 | 明矾 | 液态KNO3 | 蔗糖 |
| B | CaO | 海 水 | 铜 | 乙醇 |
| C | 胆矾 | 铝合金 | AgCl | CO2 |
| D | 氢氧化钠 | 空气 | Na2SO4溶液 | 食醋 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:10:104:109 | B. | 1:5:5×109:5×108 | C. | 1:20:1010:109 | D. | 1:10:1010:109 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤⑥⑦ | B. | ④⑤⑦ | C. | ②④⑤ | D. | ②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 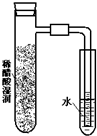 | B. | 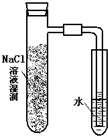 | C. | 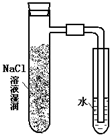 | D. | 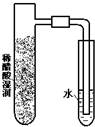 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂是碱金属元素,可以保存在煤油中 | |
| B. | 铝离子和锂离子的核外电子排布相同 | |
| C. | Li+的半径大于H-的半径 | |
| D. | 短周期中能与强碱反应产生H2的金属元素是铝,在周期表中位于第ⅢA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
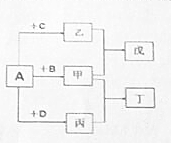 短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应.
短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应. ,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.
,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
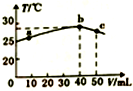
| A. | 25℃时,HA的电离平衡常数Ka约为1.43×10-3 | |
| B. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| C. | b→c的过程中,温度降低的主要原因是溶液中发生了吸热反应 | |
| D. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 92235U原子核中含有92个中子 | B. | 92235U子核外有143个电子 | ||
| C. | 92235U与92238U互为同位素 | D. | 92235U与92238U互为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com