
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.4×10-7 | 4.7×10-11 |
| A. | 溶液中水电离出的OHˉ个数:①<② | |
| B. | 溶液中分子的微粒数:H2SO3<H2CO3 | |
| C. | 溶液①中:c(Na+)>c(HCO3-)>c(OHˉ)>c(CO32-)>c(H+) | |
| D. | 溶液②中:c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OHˉ) |
分析 A.碳酸氢根离子水解促进了水的电离,而亚硫酸氢根离子电离出氢离子,抑制了水的电离;
B.酸性越强,盐的水解程度越小,据此判断亚硫酸和碳酸的微粒数大小;
C.氢离子来自碳酸氢根离子的电离和水的电离,则c(CO32-)<c(H+);
D.根据亚硫酸氢钠溶液中的电荷守恒判断.
解答 解:A.NaHCO3溶液呈碱性,碳酸氢根离子部分水解促进了水的电离,而NaHSO3溶液呈酸性,亚硫酸氢根离子电离出的氢离子抑制了水的电离,则溶液中水电离出的OHˉ个数:①>②,故A错误;
B.根据电离平衡常数K1可知,碳酸的酸性小于亚硫酸,则碳酸氢钠的水解程度大于亚硫酸氢钠,水解程度越大,生成酸分子的数目越多,则溶液中分子的微粒数:H2SO3<H2CO3,故B正确;
C.碳酸氢钠溶液呈碱性,碳酸氢根离子的电离程度大于其水解程度,但氢离子来自碳酸氢根离子的电离和水的电离,则c(CO32-)<c(H+),正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(OHˉ)>c(H+)>c(CO32-),故C错误;
D.根据溶液②中的电荷守恒可知:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OHˉ),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理为解答关键,注意掌握电荷守恒、盐的水解原理的含义及在判断离子浓度大小中的应用方法,试题培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
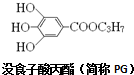
| A. | 没食子酸的分子式为C10H13O5 | B. | 1molPG可与4molNaOH反应 | ||
| C. | PG中的基团-C3H7有两种结构 | D. | PG有还原性,易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
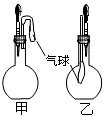 甲、乙两个装置中(如图),胶头滴管分别吸有某液体,平底烧瓶中置有其他物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).所用试剂分别是( )
甲、乙两个装置中(如图),胶头滴管分别吸有某液体,平底烧瓶中置有其他物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).所用试剂分别是( )| A. | 甲:浓硫酸和木炭 乙:浓氨水和SO2 | |
| B. | 甲:双氧水和MnO2 乙:NaOH溶液和CO2 | |
| C. | 甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2 | |
| D. | 甲:浓硫酸和蔗糖(滴有几滴水) 乙:水和氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳的结构式:O-C-O | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | F原子结构示意图: | |
| D. | MgCl2的电子式: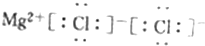 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定浓度的稀硫酸,用量筒量取浓硫酸后,未将蒸馏水洗涤量筒后的洗涤液转移至容量瓶中,使配制的溶液浓度偏小 | |
| B. | pH试纸使用时不需要润湿,红色石蕊试纸检测气体时也不需要润湿 | |
| C. | 蒸发时将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 | |
| D. | 石油的蒸馏实验中,忘记加沸石,可以先停止加热,待溶液冷却后加入沸石,再继续加热蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2能与CaO反应,可用生石灰作工业废气的脱硫剂 | |
| B. | SO2能使碘的淀粉溶液由蓝色变为无色,体现出漂白性 | |
| C. | 浓硫酸和Na2SO3反应制取SO2时,浓硫酸只表现酸性 | |
| D. | 医疗上曾用硫酸钡作X射线透视肠胃的内服药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
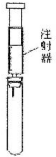
| A. | 试管中盛酚酞试液,验证氨气的水溶液呈碱性 | |
| B. | 试管中盛酸性高锰酸钾溶液,探究乙烯的还原性 | |
| C. | 试管中盛稀氢氧化钠溶液,验证CO2与NaOH反应的产物 | |
| D. | 试管中盛氢硫酸,验证SO2的氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com