
分析 根据盖斯定律,由所给热化学方程式可知,(ⅰ)×2+(ⅳ)可得到由H2和CO直接制备二甲醚的热化学方程式,以此解答该题.
解答 解:已知:(ⅰ)CO(g)+2H2(g)=CH3OH(g)△H1=-90.1kJ/mol
(ⅳ)2CH3OH(g)=CH3OCH3 (g)+H2O(g)△H4=-24.5kJ/mol
依据盖斯定律(ⅰ)×2+(ⅳ)可得:2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=(-90.1kJ/mol)×2+(-24.5kJ/mol)=-204.7kJ/mol,
故答案为:2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ/mol.
点评 本题考查热化学方程式的书写以及盖斯定律的应用,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握盖斯定律的内容及应用方法,难度不大.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
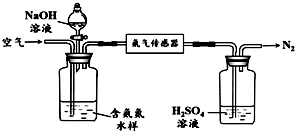

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙烷的分子数为NA | |
| B. | 1L0.1mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 23g钠的原子最外层电子数为2NA | |
| D. | 1mol甲基所含质子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
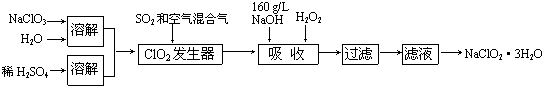
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都是天然高分子化合物 | B. | 油脂的水解产物是纯净物 | ||
| C. | 纤维素和淀粉遇碘水均显蓝色 | D. | 蛋白质水解的最终产物是氨基酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com