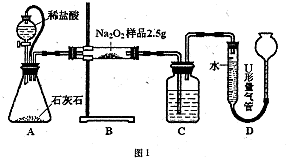
解:(1)C的作用是吸收二氧化碳,保证排水量气法获得的是氧气的体积,故答案为:NaOH溶液;
(2)A中橡皮管可以沟通锥形瓶和分液漏斗,起恒压作用,使盐酸容易滴下,并且可以避免盐酸排空气使氧气体积偏大,故答案为:起恒压作用,使盐酸容易滴下;避免盐酸排空气使氧气体积偏大;
(3)a、装置A、B中的空气会导致测得的氧气体积偏高,对测定结果产生影响,故a正确;
b、在调节U形量气管中的液面相平的过程中,排除了装置C中的空气对测定结果产生的影响,故b错误;
c、读数时U形量气管中的液面要保持向平,左高右低,所测Na
2O
2的纯度会偏大,故c正确;
d、读数时U形量气管中的液面左低右高时,所测Na
2O
2的纯度会偏小,故d错误.
故选ac.
(4)高锰酸根具有强氧化性,能将双氧水氧化为氧气,同时自身被还原为锰离子,即2MnO
4-+5H
2O
2+6H
+=2Mn
2++5O
2↑+8H
2O,故答案为:2MnO
4-+5H
2O
2+6H
+=2Mn
2++5O
2↑+8H
2O;
(5)高锰酸根是紫红色的离子,锰离子是无色的离子,当加上最后一滴高锰酸钾,溶液由无色变紫红色,证明滴定达到了终点,故答案为:溶液由无色变紫红色;
(6)解:过氧化钠和水反应生成氧气时,2Na
2O
2+2H
2O=4NaOH+O
2↑,当生成氧气的体积为112mL(标准状况)时,消耗过氧化钠的物质的量是
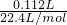
,Na
2O
2+2H
2O=2NaOH+H
2O
2,当消耗高锰酸钾(0.2×0.03)mol时,根据反应2MnO
4-+5H
2O
2+6H
+=2Mn
2++5O
2↑+8H
2O,则生成双氧水的物质的量为(0.2×0.03)×

mol,此时过氧化钠的物质的量为(0.2×0.03)×

mol,所以过氧化钠的纯度为:

×100%=78%,故答案为:

×100%=78%.
分析:(1)氢氧化钠能和二氧化碳反应,不和氧气反应;
(2)橡皮管可以沟通锥形瓶和分液漏斗中的大气压强,还可以避免盐酸排空气;
(3)若果测的氧气的量比实际值高,则过氧化钠的纯度装置就会偏高;
(4)高锰酸根具有强氧化性,能将双氧水氧化,同时紫红色变为无色;
(5)高锰酸根是紫红色的离子,锰离子是无色的离子;
(6)根据过氧化钠和水应的方程式,通过氧气的量来计算过氧化钠的量,进而计算过氧化钠的纯度.
点评:本题考查学生实验能力以及过氧化钠的性质,要求学生具有分析和解决问题的能力,难度较大.


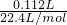 ,Na2O2+2H2O=2NaOH+H2O2,当消耗高锰酸钾(0.2×0.03)mol时,根据反应2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,则生成双氧水的物质的量为(0.2×0.03)×
,Na2O2+2H2O=2NaOH+H2O2,当消耗高锰酸钾(0.2×0.03)mol时,根据反应2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,则生成双氧水的物质的量为(0.2×0.03)× mol,此时过氧化钠的物质的量为(0.2×0.03)×
mol,此时过氧化钠的物质的量为(0.2×0.03)× mol,所以过氧化钠的纯度为:
mol,所以过氧化钠的纯度为: ×100%=78%,故答案为:
×100%=78%,故答案为: ×100%=78%.
×100%=78%.

 尿素(
尿素(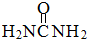 )和硼砂(Na2B4O7)在高温高压下反应可以获得硼氮化合物:
)和硼砂(Na2B4O7)在高温高压下反应可以获得硼氮化合物: