
| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
分析 既能与盐酸反应又能与氢氧化钠溶液反应的物质有:两性化合物(如Al2O3、Al(OH)3等)、弱酸的铵盐(如(NH4)2CO3、(NH4)2S等)、弱酸的酸式盐(NaHCO3、NaHS等)、单质(如Al)、氨基酸等,据此解答.
解答 解:①NaHCO3是弱酸的酸式盐,与盐酸反应生成氯化钠、二氧化碳和水,与氢氧化钠溶液反应生成碳酸钠和水,故①正确;
②Al(OH)3 是两性氢氧化物,与盐酸反应生成绿化铝和水,与氢氧化钠溶液反应生成偏铝酸钠和水,故②正确;
③(NH4)2S是弱酸弱碱盐,与盐酸反应生成氯化铵和硫化氢气体,与氢氧化钠反应生成硫化钠、氨气和水,故③正确;
④H2N-CH2-COOH是两性物质,与盐酸、氢氧化钠反应产物都是盐和水,故④正确;
故选D.
点评 本题考查了元素化合物的性质,明确物质的性质是解本题的关键,注意对既能与盐酸反应又能与氢氧化钠溶液反应的物质的积累,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 序号 | X | Y | Z |
| ① | NaHSO4溶液 | Al(OH)3 | 稀硫酸 |
| ② | CaCl2溶液 | SO2 | CaSO3 |
| ③ | HF溶液 | Si | Ba(OH)2 |
| ④ | Fe Cl3溶液 | Fe | 浓硝酸 |
| A. | 1组 | B. | 2组 | C. | 3组 | D. | 4组 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果人体缺少维生素C,易患夜盲症、干眼症等眼疾 | |
| B. | 维生素C属于脂溶性维生素,主要存在于新鲜水果和蔬菜中 | |
| C. | 维生素C具有较强的还原性,能使酸性高锰酸钾溶液褪色 | |
| D. | 富含维生素C的食物应在高温下烹调,才能充分提高维生素C的功能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HI、HBr、HCl、HF | B. | HCl、H2S、PH3、SiH4 | ||
| C. | H2O、H2S、HCl、HBr | D. | H2O、HF、NH3、CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 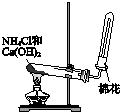 制备并收集氨气 | B. |  制备氯气 | ||
| C. | 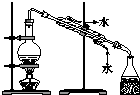 蒸馏海水得到淡水 | D. | 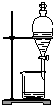 分离Na2CO3溶液与CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 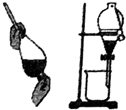 可用于分离苯和水的混合物 | |
| B. | 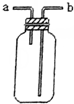 可用于收集H2、NH3、CO2、Cl2、HCl等气体 | |
| C. | 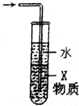 X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 | |
| D. | 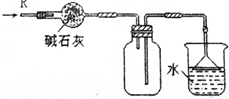 可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com