
【题目】某温度时,在500mL容器中A、B、C三种气体的物质的量随时间的变化曲线如图所示。
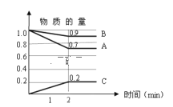
(1)由图中数据分析,该反应的化学方程式为:___________。
(2)反应开始至2min,C的平均反应速率为_________。
(3)在等温等容条件下,该反应达到化学平衡状态的依据是__(填序号)。
a.容器中气体密度不再改变 b.混合气体中c(B)不再改变
c.c(C)=c(A) d.气体的总物质质量不再改变
e.气体的平均摩尔质量不变
(4)在等温等容条件下,反应达平衡时,此时体系的压强是开始时的________倍。
【答案】3A+B![]() 2C 0.2 mol/(L·min) be 0.9
2C 0.2 mol/(L·min) be 0.9
【解析】
(1)在2min内A、B、C三种物质的物质的量的比等于化学方程式中化学计量数的比,得到其相应的化学方程式;
(2)根据V=![]() 计算;
计算;
(3)根据可逆反应达到平衡状态时 任何物质的浓度不变;物质的量的含量不变,化学反应速率不变分析判断;
(4)在等温等容条件下,体系的压强比等于气体的物质的量的比。
(1)根据图示A、B消耗,是反应物,C是生成物;在2min内A减少0.3mol,B减少0.1mol,C增加0.2mol,最终2min时反应达到平衡状态,故化学反应速率A:B:C=3:1:2,所以化学方程式为:3A+B![]() 2C;
2C;
(2)V=![]() =
=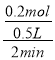 =0.2 mol/(L·min);
=0.2 mol/(L·min);
(3) a.反应前后气体的质量不变,容器的容积不变,因此任何情况下容器中气体密度都不会改变,因此不能据此判断反应是否处于平衡状态,a错误;
b.若反应达到平衡他,混合气体中任何一组分的浓度不变,故若c(B)不再改变 ,反应处于平衡状态,b正确;
c.c(C)=c(A)反应可能处于平衡状态,也可能未处于平衡状态,故不能据此判断平衡状态,c错误;
d.该反应是反应前后气体的质量始终不变,因此若反应后气体的总质量不变,不能判断为平衡状态,d错误;
e.该反应是反应前后气体物质的量改变的反应,由于气体的质量始终不变,因此若气体的平均摩尔质量不变,则气体的物质的量不变,反应处于平衡状态,e正确;
故合理选项是be;
(4)在反应开始时气体的总物质的量为n(开始)=2mol,反应达到平衡时气体的总物质的量n(平衡)=0.9mol+0.7mol+0.2mol=1.8mol,在等温等容条件下,体系的压强比等于气体的物质的量的比,所以平衡时的压强为p(平衡)=![]() p(开始)=0.9p(开始),即在等温等容条件下,反应达平衡时,此时体系的压强是开始时的0.9倍。
p(开始)=0.9p(开始),即在等温等容条件下,反应达平衡时,此时体系的压强是开始时的0.9倍。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是( )
A. 化合反应和复分解反应不可能是氧化还原反应
B. 阳离子只能得到电子被还原,阴离子只能失去电子被氧化
C. 含有最高价元素的化合物不一定具有很强的氧化性
D. 在氧化还原反应中肯定有一种元素被氧化,另一种元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的示意图如下。
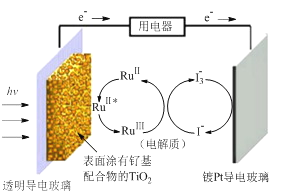
电池工作时发生的反应为:
RuII ![]() RuII *(激发态)
RuII *(激发态)
RuII *→RuIII+e-
I3-+ 2e-→3I-
RuIII+3I-→RuII++ I3-
下列关于该电池叙述错误的是 ( )
A. 电池中镀Pt导电玻璃为正极
B. 电池工作时,I-离子在镀Pt导电玻璃电极上放电
C. 电池工作时,电解质中I-和I3-浓度不会减少
D. 电池工作时,是将太阳能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:

回答下列问题:
(1)A的分子式为____________。
(2)D中含有的官能团是____________,分子中最多有____________个碳原子共平面。
(3)①的反应类型是____________,③的反应类型是____________。
(4)⑤的化学方程式为________________________________________________。
(5)B的同分异构体中能同时满足如下条件:①苯环上有两个取代基,②能发生银镜反应,共有________种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积比为6:2:2:1:1的是________(写结构简式)。
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线: _____________。
的合成路线: _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求写出下列反应的离子方程式(标明化学方程式的除外)
(1)Na2S溶液和AgNO3溶液混合:_____________。
(2)硫磺与足量浓NaOH溶液共热,其中一种产物为Na2SO3: _____________。
(3)灭火器中NaHCO3与Al2(SO4)3溶液混合: _____________。
(4)工业流程中除去溶液中Fe3+时,也可采用以下方法:将pH值调整到1.6~1.8左右,并将溶液加热至85~95℃时,加入适量Na2SO4,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,反应的离子方程式为______________。
(5)含0.300molH3PO4的水溶液滴加到含0.500molCa(OH)2的悬浊液中,反应恰好完全,生成1种难溶盐和16.2gH2O。反应的化学方程式为______________。
(6)向一定比例的CuSO4、NaCl溶液中加入一定量的Na2SO3溶液可制得CuCl白色沉淀,并有刺激性气味气体产生: _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 1 mol重水(D2O)与1 mol水(H2O)中,中子数比为5∶4
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2mol某有机物和0.2mol O2在密闭容器中恰好完全反应,生成CO2、CO和H2O。将该混合气体依次通过浓硫酸、灼热的CuO和碱石灰后(假设每一步均充分反应),浓硫酸增重7.2g,CuO固体质量减少3.2g,而碱石灰增重17.6g。
(1)产物的物质的量为:n(H2O)=____mol,n(CO)=____mol,n(CO2)=____mol。
(2)该有机物的分子式为________。
(3)等量的该有机物分别与Na和NaHCO3反应,均产生气体,且在同温同压下生成的气体体积相同,则该有机物所含官能团名称为__________,该有机物的结构简式为_________。
(4)写出该有机物与乙醇发生酯化反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在元素周期表中,A、B均为前四周期主族元素,且A位于B的下一周期。某含氧酸盐X的化学式为ABO3。请回答:
(1)若常温下B的单质为黄绿色气体。
①A在元素周期表中的位置是_______________________。
②下列说法正确的是_________(填代号)。
a.A单质的熔点比B单质的熔点低
b.A的简单离子半径比B的简单离子半径大
c.A、B元素的最高价氧化物对应的水化物都是强电解质
d.化合物X中既含有离子键又含有共价键
③400℃时,X能发生分解反应生成两种盐,其物质的量之比为1∶3,其中一种是无氧酸盐。该反应的化学方程式为_____________________________________________。
(2)若X能与稀硫酸反应,生成无色、无味的气体。
①该气体分子的电子式为______________________。
②X在水中持续加热,发生水解反应,生成一种更难溶的物质并逸出气体,反应的化学方程式为__________________________________________。
③X可用作防火涂层,其原因是:a.高温下X发生分解反应时,吸收大量的热;
b. __________________________________________(任写一种)。
(3)若X难溶于水,在空气中易氧化变质,B元素原子的最外层电子数是其电子层数的2倍。X能快速消除自来水中的C1O-,该反应的离子方程式为______________________________________。
(4)用一个化学方程式证明上述(1)、(3)两种情况下化合物X中B元素非金属性强弱________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com