
| A.酸性强弱:HBrO4>HClO4 | B.原子半径大小:Na>S |
| C.碱性强弱:NaOH>LiOH | D.还原性强弱:F-<Cl- |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 元素代号 | A | B | D | E | G | H | J | L |
| 常见化合价 | -1 | -2 | +4、-4 | +6、+4、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径(pm) | 64 | 66 | 77 | 104 | 110 | 143 | 160 | 186 |
 (1)A、H、L对应离子的半径由大到小的顺序是(用离子符号表示) ;
(1)A、H、L对应离子的半径由大到小的顺序是(用离子符号表示) ; (2)A与L所形成的化合物的电子式 ;
(2)A与L所形成的化合物的电子式 ; (3)DB2的结构式为 ;
(3)DB2的结构式为 ; (4)D的最高正价氧化物与L的最高正价氧化物对应水化物X的溶液(足量)发生反应的离子方程式 ;
(4)D的最高正价氧化物与L的最高正价氧化物对应水化物X的溶液(足量)发生反应的离子方程式 ; (5)E的最高正价氧化物对应水化物y的浓溶液与Cu发生反应的化学方程式为
(5)E的最高正价氧化物对应水化物y的浓溶液与Cu发生反应的化学方程式为  。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题







族 周期 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | | ⑧ | |
 (2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。 (3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。 (4)由表中两种元素的原子按1︰1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) _。
(4)由表中两种元素的原子按1︰1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) _。 a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4 (5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
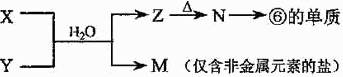
 X溶液与Y溶液反应的离子方程式为 ,
X溶液与Y溶液反应的离子方程式为 , N→⑥的单质的化学方程式为 。
N→⑥的单质的化学方程式为 。 常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至 。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 10电子粒子 | CH4、NH3、H2O、HF、Na+、Al3+、NH4 +、OH- |
| 18电子粒子 | H2S、HCl、K+ 、Cl-、C2H6 …… |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
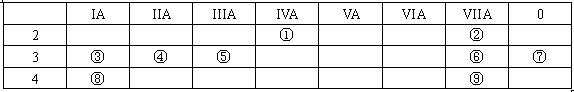 (1)⑨的元素符号是__________
(1)⑨的元素符号是__________查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
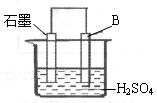
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.32 | B.67 | C.99 | D.166 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com