
【题目】一定温度下,恒容密闭容器中发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O)(g),下列叙述不能说明该反应达平衡的是( )
4NO(g)+6H2O)(g),下列叙述不能说明该反应达平衡的是( )
A.V(正)(O2)=![]() V(逆)(NO)B.密闭容器内气体的密度不再改变
V(逆)(NO)B.密闭容器内气体的密度不再改变
C.密闭容器的压强不变D.氮气的浓度不再改变
科目:高中化学 来源: 题型:
【题目】为了防止氮氧化物对空气的污染,人们采取了很多措施。
(1)如用CH4催化还原NO2可以消除氮氧化物的污染,发生的反应如下: CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1。
N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1。
①下列有关说法正确的是_________。
A.在容器中充入1mol CH4和2 mol NO2,当体系中n(CH4)/n(NO2)比值不随时间变化时,反应达到平衡状态
B.恒温恒容时,当混合气体的密度不随时间变化时,该反应达到平衡状态
C.体系达到平衡后,升高温度,体系中的混合气体的平均相对分子质量增大
D.恒温恒压时,充入CH4有利于提高氮氧化物的转化率
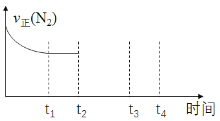
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在右图中补充画出从t2到t4时刻v正(N2) 随时间的变化曲线:____________
(2)现有的汽车尾气处理的原理是:NO(g)+2CO(g)![]() N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染___________。
N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染___________。
反应 | 25℃时的平衡常数 | 焓变 |
反应I:2NO(g) | K1=1×1030 | △H=-180.5kJ/mol |
反应II:2CO2 (g) | K2=4×10-92 | △H= +566.0kJ/mol |
(3)用NH3催化还原NOx也可以消除氮氧化物的污染,其反应原理为:NO(g) +NO2(g)+2NH3(g)![]() 2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=________________。(用只含P的式子表示,且化至最简式)。(备注:对于有气体参加的反应,可用某组分的平衡分压代替物质的量浓度计算平衡常数,记作KP。如p(NO2)为NO2的平衡分压,p(NO2)=x(NO2)p,p为平衡总压,x(NO2)为平衡体系中NO2的物质的量分数。)
2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=________________。(用只含P的式子表示,且化至最简式)。(备注:对于有气体参加的反应,可用某组分的平衡分压代替物质的量浓度计算平衡常数,记作KP。如p(NO2)为NO2的平衡分压,p(NO2)=x(NO2)p,p为平衡总压,x(NO2)为平衡体系中NO2的物质的量分数。)
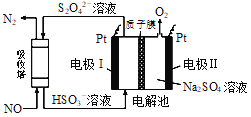
(4)用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),电极I发生的电极反应为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

A. 图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家屠呦呦因发明抗疟疾新药青蒿素而获得2015年诺贝尔生理学或医学奖。青蒿素的分子式为C15H22O5。下列有关青蒿素的说法正确的是( )
A.青蒿素是由碳的氧化物和氢的氧化物组成的混合物
B.青蒿素具有可燃性,可燃性属于物理性质
C.青蒿素中C、H、O的质量比为90∶11∶40
D.青蒿素的相对分子质量为141
查看答案和解析>>
科目:高中化学 来源: 题型:
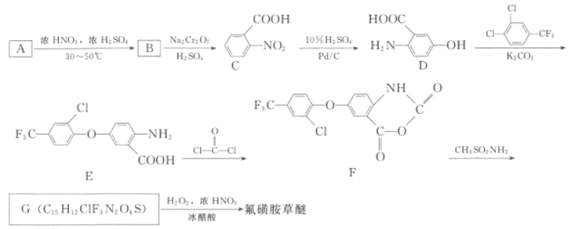
【题目】氟磺胺草醚(结构式为 ,化学式为C13H10ClF3N2O6S)为高效豆田芽后除草剂,在杂草萌生后施药可有效防除一年生阔叶杂草。其合成方法如图:
,化学式为C13H10ClF3N2O6S)为高效豆田芽后除草剂,在杂草萌生后施药可有效防除一年生阔叶杂草。其合成方法如图:
回答下列问题:
(1)已知A的分子式为C7H8,则其结构简式为_______________。
(2)写出从A→B反应的化学方程式:______________________。与B具有相同官能团的B的同分异构体有___________个,其中核磁共振氢谱吸收峰面积比值为2:2:2:1的是___________(写结构简式)
(3)上述反应中,B→C属于___________反应,E→F属于___________反应。
(4)G的结构简式为___________。
(5)仿照题给价息,写出以 和
和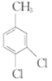 为原料合成
为原料合成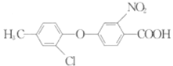 的流程图(其他无机试剂自选)。_________________
的流程图(其他无机试剂自选)。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气在氯气中燃烧生成氯化氢,同时产生苍白色火焰,下列说法正确的是
A.该反应是放热反应B.该反应是吸热反应
C.断裂H-H键放出热量D.形成H-Cl键吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含SO2的硫酸工业尾气联合制备(NH4)2SO4和MnxOy,其工艺流和如下:

(1)反应I的化学方程式为__________;反应II控制温度60℃~70℃之间的原因是________。反应I到反应II的过程中可循环利用的物质是__________________。
(2)反应III中以SO2作___________剂。
(3)MnCO3的作用是除去滤液中的Fe3+,写出除去Fe3+的离子反应方程式___________。
(4)MnS的作用是提供S2-除去Ni2+和Cu2+;当Ni2+恰好完全沉淀时[c(Ni2+)= 1.0×10-5 mol·L -1〕,溶被中Cu2+的浓度是_______ mol·L -1(已知Ksp(CuS)=8.4×10-45, Ksp(NiS)=1.4×10-24,) 。
(5)从MnSO4溶液中获得MnSO4·nH2O的方法是_____________。
(6) “锻烧”时温度与剩余固体质量变化曲线如下图:

该曲线中B点所表示的固体氧化物的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮、磷化合物在生活和生产中有许多重要用途,如:(CH3)3N、磷化硼(BP)、磷青铜(Cu3SnP)等。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为_________,据此推测,锡的最高正价是_________ 。
(2)与P同周期的主族元素中,电负性比P小的元素有____种,第一电离能比P大有____种。
(3)PH3分子的空间构型为___________。PH3的键角小于NH3的原因是__________。
(4)化合物(CH3)3N能溶于水,试解析其原因____________。

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为________,磷原子的配位数为________。
②已知晶胞边长a pm,阿伏加德罗常数为NA。则磷化硼晶体的密度为______ g/cm3。
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com