
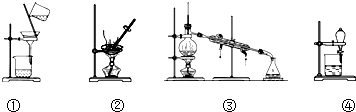
| A. | 除去KCl溶液中的K2CO3,加入适量Ca(NO3)2溶液,再用①装置分离 | |
| B. | 用②装置除去自来水中的Cl-等杂质 | |
| C. | 回收碘的CCl4溶液中的CCl4,可选用③装置 | |
| D. | 分离水和植物油,选用④装置,下层的植物油可从分液漏斗的下层放出 |
分析 A.加入硝酸钙会引进新的杂质离子;
B.蒸发浓缩不能除去自来水中的氯离子;
C.碘易溶于四氯化碳,应该采用蒸馏方法分离;
D.互不相溶的液体采用分液方法分离,分液时下层液体从下口倒出,上层液体从上口倒出.
解答 解:A.加入硝酸钙会引进新的杂质离子,应该用氯化钙溶液除去KCl溶液中的K2CO3,然后采用过滤方法分离,故A错误;
B.蒸发浓缩不能除去自来水中的氯离子,应该采用蒸馏方法除杂,故B错误;
C.碘易溶于四氯化碳,应该采用蒸馏方法分离,且温度计测量馏分温度,故C正确;
D.互不相溶的液体采用分液方法分离,分液时下层液体从下口倒出,上层液体从上口倒出,植物油和水不互溶,且植物油密度小于水,所以植物油从上口倒出,水从下口倒出,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质分离和提纯、实验基本操作,明确实验原理、基本操作方法是解本题关键,知道常见物质分离和提纯方法,题目难度不大.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:选择题
| A. | 锂离子电池充电时电池反应为C6Li+Li1-xMO2═LiMO2+C6Li1-x | |
| B. | 电池反应中,锂、锌、银、铅各失去1mol电子,金属锌所消耗的质量最小 | |
| C. | 锂离子电池放电时电池内部Li+向负极移动 | |
| D. | 锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-═C6Li |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将搪瓷快餐杯脱瓷的部位用醇酸油漆涂严实,防止杯被腐蚀 | |
| B. | 将自行车的铁链条涂上植物油,防止链条被腐蚀 | |
| C. | 将埋在地下的铜水管缠上废铁丝,防止水管被腐蚀 | |
| D. | 将待埋在地下的木头桩先用火将表面烧焦,防止木材被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下VL氨气溶解在1L水中(水的密度近似为1g/L),所得溶液的密度为ρg/mL,所配溶液的物质的量浓度c=$\frac{1000Vρ}{(17V+22400)}$ | |
| B. | 只含0.1mol、NH4+、0.1molCa2+、0.1molCO32-和0.1molCl-的溶液 | |
| C. | 质量分数为a%,物质的量浓度为c1mol/L的稀硫酸蒸发水后,其质量分数为2a%,物质的量浓度为c2mol/L,则2c1>c2 | |
| D. | 仅用1 000 mL的容量瓶、烧杯、玻璃棒、量筒、58.5 g NaCl固体和水配制1 L 1 mol/L的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | 锌铜合金质量/g | 硫酸/mL | 硫酸锌/g |
| 1 | 2.0 | 56 | 4.83 |
| 2 | 3.0 | 56 | |
| 3 | 4.0 | 56 | 9.66 |
| 4 | 5.0 | 56 | 9.66 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含分子数相同 | B. | 质量之比为16:17 | ||
| C. | 所含氢原子的物质的量之比为3:4 | D. | 密度之比为17:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③ | C. | ①②③ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02 mol/L | B. | 0.05 mol/L | C. | 0.25 mol/L | D. | 0.5 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com