
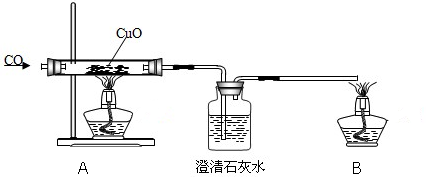
分析 在加热条件下CO与CuO发生氧化还原反应,可生成二氧化碳,二氧化碳可使澄清石灰水变浑浊,B用于除去尾气,防止CO污染环境.
(1)实验时应避免CO污染环境;
(2)一氧化碳具有还原性加热条件下含有氧化铜生成铜和二氧化碳;二氧化碳与澄清石灰水反应生成碳酸钙,一氧化碳有毒,不能直接排放到空气中;
(3)实验操作时应从安全的角度考虑,应防止爆炸;
(4)实验时先通入CO,以排除空气,无需在CO通入CuO之前,先通入澄清石灰水.
解答 解:在加热条件下CO与CuO发生氧化还原反应,可生成二氧化碳,二氧化碳可使澄清石灰水变浑浊,B用于除去尾气,防止CO污染环境.
(1)一氧化碳还原氧化铜的步骤是先通入一氧化碳排净装置内空气防止爆炸,所以有一氧化碳通过就要点燃B处酒精灯,防止一氧化碳污染空气;
故答案为:B;A;
(2)硬质试管中是一氧化碳在加热条件下和氧化铜反应生成铜和二氧化碳,反应的化学方程式为:CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 ,二氧化碳能使澄清石灰水变浑浊;
O有毒,不能直接排放,用酒精灯点燃未反应的CO,可防止污染环境.
故答案为:CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 ;澄清石灰水变浑浊;点燃未反应的CO,防止污染环境;
(3)将酒精灯合二为一,将尾气导管出口旋转到A的火焰上的做法不合理,因为CO点燃在前,CuO加热在后,不能同时进行,否则可能引起爆炸,
故答案为:不合理;因为CO点燃在前,CuO加热在后,不能同时进行,否则可能引起爆炸;
(4)在CO通人CuO前应先通入澄清石灰水的设计不必要,因为加热CuO前必须先通CO,此时即可观察CO是否能使澄清石灰水变浑浊,
故答案为:不必要.
点评 本题以实验方案设计为载体考查了元素化合物的性质、氧化还原反应,题目难度中等,注意掌握性质实验方案的设计与评价方法,试题综合性较强,需要围绕实验原理解答,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:推断题
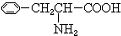
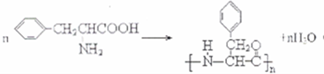 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X-、Y-、Z-、W-中Z-还原性最强 | B. | X2、Y2、Z2、W2中Z2的氧化性最强 | ||
| C. | 2Z-+Y2═-+Z2不能向右进行 | D. | 还原性X->Y- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
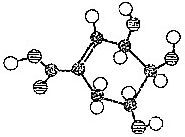
 的化学方程式:
的化学方程式: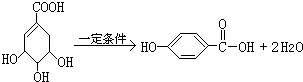 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com