
A、 为证明非金属性强弱:Cl>C>Si |
B、 为制备少量CO2并控制反应 |
C、 为制备并收集少量NO气体 |
D、 量取0.10 mol?L-1 KOH溶液20.00 mL |


科目:高中化学 来源: 题型:
| A、等于10s |
| B、等于12s |
| C、大于12s |
| D、小于12s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,11.2 LCO2所含的原子数为1.5NA | ||
| B、常温常压下,48 g O3含有的氧原子数为3NA | ||
| C、标准状况下,22.4 L SO3中所含原子数为4NA | ||
D、标准状况下,1 L水所含分子数为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Z>W>R |
| B、对应的氢化物的热稳定性:R>W |
| C、W离子的还原性强于R离子 |
| D、W与X、W与Z形成的化合物的化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
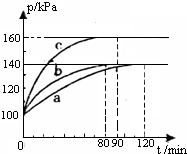 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下.
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下.查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 煤是重要的能,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
| ||
| O2/H2O |
| n(O2) |
| n(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在中和热测定实验中,为准确测得反应前后的温差,应将已分别测得温度的氢氧化钠溶液与盐酸在隔热的容器中快速混合,并不断搅拌,用温度计测量混合液的最高温度 |
| B、往海带灰的浸泡液中加入过量的氯水,保证I-完全氧化为I2 |
| C、将溴乙烷与氢氧化钾混合液加热,再滴加硝酸银溶液,观察有淡黄色沉淀生成,可证明溴乙烷中含有溴 |
| D、润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、按系统命名法,化合物 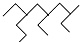 的名称为2,4-二乙基-6-丙基辛烷 的名称为2,4-二乙基-6-丙基辛烷 |
| B、若两种二肽互为同分异构体,则二者的水解产物一定不相同 |
| C、醋酸和硬脂酸互为同系物,C2H6和C9H20也一定互为同系物 |
D、1mol某有机物的结构简式为 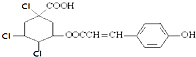 通过消去反应脱去1 molHCl时,能得到 5 种不同产物(不考虑立体异构) 通过消去反应脱去1 molHCl时,能得到 5 种不同产物(不考虑立体异构) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com