
| 充电 |
| 放电 |
| A、放电时,电池是将化学能转化为电能 |
| B、放电时,正极反应式:LiFeSiO4+Li++e-═Li2SiO4 |
| C、充电时,毎生成1molLiFeSiO4转移2mol电子 |
| D、充电时,Li+向阴极移动 |


科目:高中化学 来源: 题型:
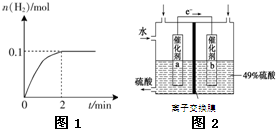 氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源.目前分解水制氢气的工业制法之一是“硫-碘循环”,主要涉及下列反应:
氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源.目前分解水制氢气的工业制法之一是“硫-碘循环”,主要涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、NH4+、NO3-、MnO4- |
| B、K +、SO42-、OH-、CO32- |
| C、K +、Fe3+、Cl-、Br- |
| D、Ba2+、Na+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 373 | 473 | 573 | 673 | 773 |
| K | 3.35×109 | 1.00×107 | 2.45×105 | 1.88×104 | 2.99×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B、纯铝制品在空气中表面逐渐失去金属光泽 |
| C、锌与稀硫酸反应时,往溶液中滴入几滴CuSO4溶液可以使反应变快 |
| D、与电源的负极相连的金属不易生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学键的断裂和形成是化学反应中能量变化的主要原因 |
| B、放热反应和吸热反应决定于反应物的总能量与生成物的总能量的相对大小 |
| C、化学反应中能量变化,通常主要表现为热量的变化------放热或者吸热 |
| D、凡经加热而发生的化学反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
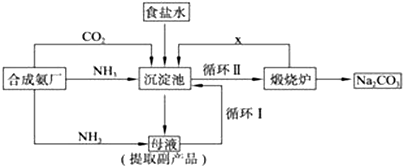
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com