
氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g);△H=―92.4kJ/mol他因此获得了1918年诺贝尔化学奖。试回答下列问题:
2NH3(g);△H=―92.4kJ/mol他因此获得了1918年诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A 采用较高压强(20Mpa~50Mpa) B 采用500℃的高温 C 用铁触媒作催化剂
D 将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
(2)下图是实验室模拟工业法合成氨的简易装置。简述检验有氨气生成的方法 。

(3)在298K时,将10mol N2和30mol H2放入合成塔中,为何放出的热量小于924kJ?

(4)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如图。正极的电极反应式
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

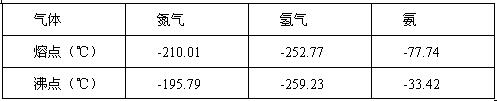
反应体系中各组分的部分性质见下表:
气体 | 氮气 | 氢气 | 氨 |
熔点/℃ | -210.01 | -252.77 | -77.74 |
沸点/℃ | -195.79 | -259.23 | -33.42 |
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程,即反应后通过把混合气体的温度降低到____________,使混合气体分离出产品,N2、H2继续循环。写出该反应的化学平衡常数表达式:K=____________。
(2)运用化学反应速率和化学平衡的观点说明工业上采用“使混合气体分离出产品,N2、H2继续循环”的生产措施的理由:___________________________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_____________________________。
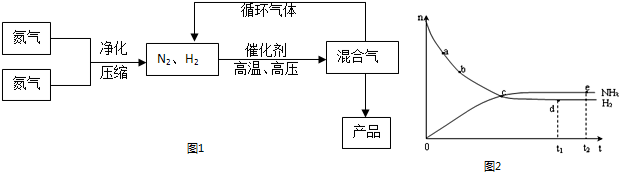
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图甲所示。下列叙述正确的是____________。
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图甲所示。下列叙述正确的是____________。
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比图中d点的值大
(5)1998年希腊亚里斯多德大学的Marncellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如下图乙。阴极的电极反应式为__________________________________________________________________。


甲 乙
查看答案和解析>>
科目:高中化学 来源:2013届安徽省高二第二次月考理科综合试题(化学部分) 题型:填空题
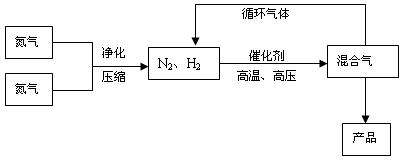
(15分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)  2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:

|
气体 |
氮气 |
氢气 |
氨 |
|
熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
|
沸点(℃) |
-195.79 |
-259.23 |
-33.42 |
反应体系中各组分的部分性质见上表:
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 ℃使混合气体分离出来产品;继续循环的气体是 。
(2)工业上采取用上述(1)操作的目的:
。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________ 。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: N2(g)+3H2(g) 2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是

A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻, n(H2)比上图中d点的值大
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是最重要的氮肥,是产量最大的化工产品之一,其合成原理为
N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4KJ/moL。试回答下列问题:
2NH3(g) △H=-92.4KJ/moL。试回答下列问题:
氨的合成是一个可逆反应,为了探索合成氨的最佳条件,人们进行了大量的研究。
(1) 下列有关做法不适宜的是( )
A、常采用循环法,使未转化的氮气和氢气得到充分的利用。
B 、综合考虑各方面的因素,压强控制在20―50MPa之间为宜
C、利用电解水制氢气,作为合成氨的原料,
D、使用铁触媒为催化剂,在5000C时获得最大催化效益。
(2)合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A 、采用较高压强(20―50MPa)
B、采用5000C的高温
C、用铁触媒为催化剂
D、将生产的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
(3)在298K时,将10moL N2和30moL H2放入合成塔中,为何放出的热量小于924KJ?
(4)怎样知道在合成氨工业有氨气生成?
如果提高单位时间内氨气的产量,对温度而言,在 (填高温或低温)下有利.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术
叫哈伯法,是德国人哈伯1905年发明的,其合成原理为:N2(g) + 3H2(g) ![]() 2NH3(g),△H=-92.4 kJ/mol,△S = -198.3J·mol-1·K-1。他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g),△H=-92.4 kJ/mol,△S = -198.3J·mol-1·K-1。他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
反应体系中各组分的部分性质见下表:
(1)下列说法正确的是
A. 因为△H= -92.4 kJ/mol,所以该反应一定能自发进行
B. 因为△S = -198.3J·mol-1·K-1所以该反应一定不能自发进行
C. 该反应在一定条件下可能自发进行。
(2)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使混合气体分离出来产品;继续循环的气体是 。
(3)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。
①若容器容积恒定,达到平衡时,气体的压强为原来的7/8,则N2的转化率а1= ,此时反应放热 kJ;
②若容器压强恒定,则达到平衡时,容器中N2的转化率а2 а1(填“>、<或=”)。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)![]() 2NH3(g) 反应的影响。
2NH3(g) 反应的影响。
实验结果如图所示:(图中T表示温度,n表示物质的量)
① 图像中T2和T1的关系是:T2 T1,(填“高于”“低于”“等于”“无法确定”)
② 比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最高的是 (填字母)。
③ 在起始体系中加入N2的物质的量为n/3mol时,反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。(不用写单位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com