
向一定质量CaCl2和HCl的混合溶液中逐滴加入浓度为1.000 mol·L-1的Na2CO3溶液,反应过程中加入的Na2CO3溶液的体积与产生沉淀或气体的质量关系如图所示。
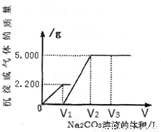
(1)样品中物质的量之比n (CaCl2) :n(HCl)=_____________。
(2)V2=_____________L。
科目:高中化学 来源:2016-2017学年山东省潍坊市高一下学期第一次月考模拟测试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量的氨水:Al3+ + 4NH3·H2O =[Al(OH)4]-+4 NH4+
B. 澄清石灰水与苏打溶液混合:Ca2+ + CO32- = CaCO3↓
C. Na[ Al(OH)4] 溶液中加入过量盐酸:AlO2- + H++ H2O= Al(OH)3↓
D. 氯化亚铁溶液中通入氯气:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
查看答案和解析>>
科目:高中化学 来源:2017届山东省菏泽市高三一模理综化学试卷(解析版) 题型:选择题
用NA表示阿伏伽德罗常数的数值,下列说法正确的是
A. 1molNa218O2中所含的中子数为42NA
B. 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA
C. 2mol·L-1的FeCl3溶液溶液中含有的Fe3+数目小于2NA
D. 1mol环己烷中含有的共价键数为12NA
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省抚顺市高三3月模拟考试理科综合化学试卷(解析版) 题型:简答题
德国化学家哈伯(F. Haber, 1868-1930)发明的合成氨技术使大气中的氮气变成了生产氮肥的永不枯竭的廉价来源,从而使农业生产依赖土壤的程度减弱,解决了地球上因粮食不足导致的饥饿和死亡问题。因此这位解救世界粮食危机的化学天才获得了1918年诺贝尔化学奖。现在我们在实验室模拟工业制氨的过程,以探究外界条件对平衡的影响。
查阅资料,获得以下键能数据:
化学键 | N≡N | H-H | N-H |
键能/(kJ/mol) | 946 | 436 | 391 |
(1)计算工业合成氨反应的反应热:N2(g)+3H2(g)  2NH3(g) △H=________ kJ/mol
2NH3(g) △H=________ kJ/mol
(2)一定温度下,向一个恒压容器中充入N20.6mol,H2 0 .5mol,在一定温度下进行反应:N2(g)+3H2(g)  2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
①该温度时容器中平衡体系的平衡常数是______________。
②若保持平衡时的温度和压强不变,继续向平衡体系中通入0.9mol N2,则平衡将_______(填“正向”,“逆向”或“不”)移动。
(3)在两个压强相等,温度分别为T1和T2的容器中充入由1 mol N2和3 molH2组成的混合气体,发生反应N2(g)+3H2(g)  2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是______________
2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是______________
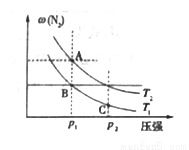
a.A、 B、 C三点的平衡常数大小关系:KA<KB<KC
b.B点和C点的H2浓度大小关系:B<C
c.A点和B点混合气体的密度大小关系:A<B
d.A点和C点混合气体的平均相对分子质量大小关系:A>C
(4)合成氨工业会产生大量副产物CO2,工业上常用高浓度的K2CO3溶液吸收CO2,,得溶液X,再利用电解法K2CO3溶液再生,其装置如图所示:
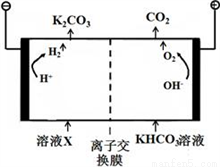
①在阳极区发生的反应包括____________________和H++ HCO3-=H2O+CO2↑。
②简述CO32-在阴极区再生的原理________________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
2H2(g)+ O2(g)=2H2O(g) Δ H1=-484kJ/mol
2CH3OH(g)+3 O2(g)=2CO2 (g)+4H2O(g) Δ H2=-1352kJ/mol
写出CO2和H2生成1molCH3OH(g)的热化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省抚顺市高三3月模拟考试理科综合化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1.0 L 0. 5mol/L的Na2SO4水溶液中含有的氧原子数为2NA
B. 用含有0.2mo1 FeCl3的饱和溶液配制的氢氧化铁胶体中胶粒数等于0.2NA
C. 1. 0gH218O与D2O的混合物所含中子数为0.5NA
D. 标准状况下,11.2L氯气与足量铁粉充分反应,转移的电予数为1.5NA
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:选择题
将一定量的氯气通入50mL 10.00mol·L-1的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、NaClO3共存体系(不考虑氯气和水的反应)。下列说法正确的是
A. 若反应中转移的电子为nmol,则0.25 < n < 0.5
B. 溶液中n(NaCl):n(NaClO):n(NaClO3)可能为3
C. 与NaOH反应的氯气物质的量:0.25 mol < n (Cl2) < 0.75mol
D. 当溶液中n(NaClO):n(NaClO3) = 5:1时,反应的离子方程式为:8Cl2+16OH-=10Cl-+5ClO-+ClO3-+8H2O
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:选择题
锌一空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时,下列说法正确的是
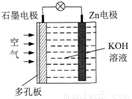
A. Zn电极是该电池的正极
B. Zn电极的电极反应:Zn+H2O-2e-=ZnO+2H+
C. OH-向石墨电极移动
D. 氧气在石墨电极上发生还原反应
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省大庆市高三第二次教学质量检测(二模)理科综合化学试卷(解析版) 题型:简答题
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成α-萜品醇G的路线之一如下:
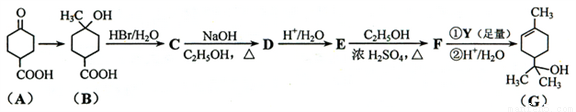
已知:
请回答下列问题:
(1)A的分子式为______;G所含官能团的名称是______。
(2)C→D的反应类型为____;该反应的副产物中与D互为同分异构体的化合物的结构简式为______。
(3)E→F反应中加入试剂浓H2SO4的作用是_______;F中混有少量C2H5OH和E,最好用_____(填字母)洗涤除去。
A.水 B.氢氧化钠溶液 C.浓硫酸 D.饱和碳酸钠溶液
(5)B在一定条件下发生聚合反应的化学方程式为______;写出同时满足下列条件的B的链状同分异构体的结构简式________。
①核磁共振氢谱有2个吸收峰。 ②能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省四地六校高一下学期第一次联考(3月)化学试卷(解析版) 题型:选择题
下列解释过程或事实的方程式不正确的是( )
A. 氨气遇浓盐酸产生白烟:NH3+HCl═NH4Cl
B. NH4Cl与NaOH溶液反应的离子方程式:NH4++OH﹣═NH3↑+H2O
C. SO2使Br2水褪色:SO2 +Br2+2H2O═2HBr+H2SO4
D. SO2溶于水:SO2+2H2O H2SO3
H2SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com