
【题目】某混合物X由Na2O、Fe2O3、Cu、SiO2中的一种或几种物质组成。某兴趣小组以两种途径分别对X进行如下实验探究。

下列有关说法不正确的是( )
A.无法判断混合物中是否含有Na2O
B.由II可知X中一定存在SiO2
C.1.92g 固体成分为Cu
D.15.6g混合物X中m(Fe2O3):m(Cu)=1:1
【答案】A
【解析】途径a:15.6gX和过量盐酸反应生成蓝色溶液,所以是铜离子的颜色,但是金属Cu和盐酸不反应,所以一定含有氧化铁,和盐酸反应生成的三价铁离子可以和金属铜反应,二氧化硅可以和氢氧化钠反应,4.92g固体和氢氧化钠反应后,固体质量减少了3.0g,所以该固体为二氧化硅,质量为3.0g,涉及的反应有:Fe2O3+6H+=2Fe3++3H2O;Cu+2Fe3+=2Fe2++Cu2+,SiO2+2NaOH=Na2SiO3+H2O,又Cu与NaOH不反应,1.92g固体只含Cu;结合途径b可知15.6gX和足量水反应,固体质量变为6.4g,固体质量减少15.6g-6.4g=9.2g,固体中一定还有氧化钠,其质量为9.2g。A.15.6gX和足量水反应,固体质量变为6.4g,只有氧化钠与水反应,混合物中一定含有Na2O,故A错误;B.由以上分析可知X中一定存在SiO2,故B正确;C.Cu与NaOH不反应,1.92g固体只含Cu,故C正确;D.设氧化铁的物质的量是x,金属铜的物质的量是y,由Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=2Fe2++Cu2+得出:Fe2O3~2Fe3+~Cu,则160x+64y=6.4,64y-64x=1.92,解得x=0.02mol,y=0.05mol,所以氧化铁的质量为0.02mol×160g/mol=3.2g,金属铜的质量为0.05mol×64g/mol=3.2g,则原混合物中m(Fe2O3):m(Cu)=1:1,故D正确;故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列物质的沸点由高到低排列的是
①CH3(CH2)2CH3
②CH3(CH2)3CH3
③(CH3)3CH
④(CH3)2CHCH2CH3.
A.④②①③
B.②④①③
C.④①②③
D.②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同质量的锌与稀硫酸反应,欲使反应速率最大,选择下列组合中的反应条件( )
①锌粒②锌片
③锌粉
④10%的硫酸
⑤20%的硫酸
⑥98%的硫酸
⑦加热
⑧用冰冷却
⑨不断搅拌
⑩迅速加入锌后静置.
A.②⑤⑦⑩
B.①④⑧⑩
C.③⑤⑦⑨
D.③⑥⑦⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠(NaCN)是一种重要的化工原料、有剧毒,一旦泄露可以通过喷洒双氧水或硫代硫酸钠溶液来处理。
已知:氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3==NaSCN+Na2SO3回答下列问题:
(1)氰化物中碳的化合价为___________;用硫代硫酸钠处理1mol NaCN时,反应中转移电子的物质的量为 。
(2) NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是 。
(3)某化学兴趣小组在实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】制备Na2S2O3,其实验室装置如下:
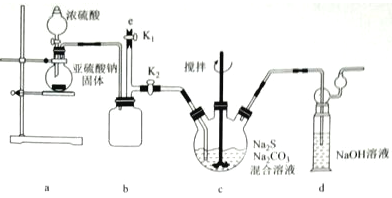
b装置的作用是___________;c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有_____________。
实验结束后,在e处最好连接盛____________(填化学式)的注射器,再关闭K2打开K1,以防拆除装置过程中的有害气体污染空气。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先于Ag+反应。
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
滴定时1.000×10-4mol/L的标准AgNO3溶液应用_________(填仪器名称)盛装;滴定终点时的现象是___________。
处理后的废水是否达到排放标准:__________(填“是”或“否”),其依据是__________(用实验数据说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于实验I~IV的说法正确的是( )

A.实验I:逐滴滴加盐酸时,试管中立即产生大量气泡
B.实验II:可比较氯、碳、硅三种元素的非金属性强弱
C.实验III:从饱和食盐水中提取NaCl晶体
D.装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家用DNA制造出一种臂长只有7nm的纳米级镊子,这种镊子能钳起分子或原子,并对它们随意组合。下列分散系中分散质的微粒直径与纳米粒子具有相同数量级的是( )
A.溶液 B.胶体 C.悬浊液 D.乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯水加热至较高温度,下列叙述正确的是( )
A. 水的离子积变大、pH变小、呈酸性
B. 水的离子积不变、pH不变、呈中性
C. 水的离子积变大、pH变小、呈中性
D. 水的离子积变小、pH变大、呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下CO2和H2可发生反应:CO2(g)+ H2(g)![]() CO (g)+H2O(g) △H
CO (g)+H2O(g) △H
已知:①CO和H2的燃烧热分别为-283.0 kJmol-1 和-285.8kJmol-1
②H2O(l)= H2O(g) △H=+44.0KJ·mol-1
(1)写出表示H2燃烧热的热化学方程式____________________。
CO2(g)+ H2(g)![]() CO(g)+ H2O(g) △H1=___________KJ·mol-1
CO(g)+ H2O(g) △H1=___________KJ·mol-1
(2)有利于提高CO2平衡转化率的措施有__________。
A.加压 B.升温
C.增大CO2浓度 D.投料比不变,增加反应物的浓度
(3)若CO2和H2初始投料比为1:1,反应达平衡时CO在平衡混和气中的体积分数为25%,则CO2的转化率为_________,该反应的平衡常数为_________,若CO2和H2初始投料比改为1:2,则CO2的平衡转化率为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com