
| A.Li2NH中N的化合价是-1 |
| B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+和H+的离子半径相等 |
| D.此法储氢和钢瓶储氢的原理相同 |


科目:高中化学 来源:不详 题型:单选题
| A.电解AlCl3、FeCl3、CuCl2的混合溶液,在阴极上依次析出Cu、Fe、Al |
| B.电解CuSO4溶液一段时间后,加入适量Cu(OH)2可以使溶液恢复至原状态 |
| C.铅蓄电池在充电时,连接电源正极发生的电极反应为PbSO4+2e-=Pb+SO42- |
| D.将钢闸门与直流电流的负极相连,可防止钢闸门腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
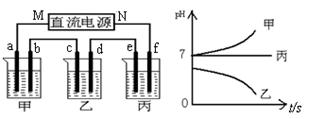
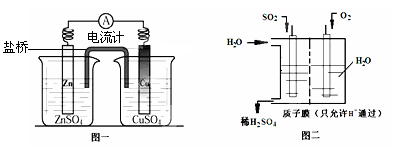
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.不锈钢不易生锈是因为表面有致密保护层 |
| B.纯银的器皿在空气中久置表面变暗是因为发生电化学腐蚀 |
| C.当镀锌铁制品的镀层破损时,镀层还能对铁制品起保护作用 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
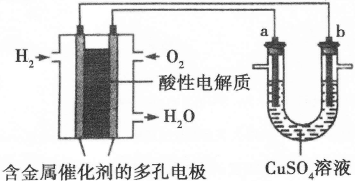
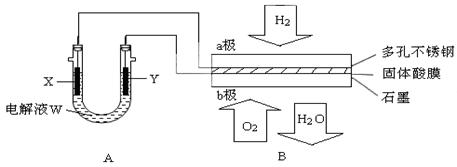
| A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 |
| B.U型管中,OH—在a极放电 |
| C.若a为纯净金属,b为粗制金属,该装置可用于粗制金属的精炼 |
| D.电子经导线流入b电极 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
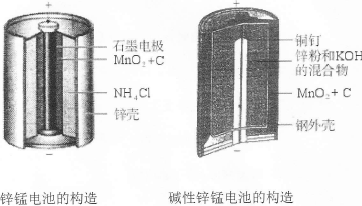
| A.金属腐蚀就是金属原子失去电子被还原的过程 |
| B.钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e→4OH- |
| C.氯碱工业中,阳极发生的反应为:2Cl-–2e→Cl2↑ |
| D.镀锌铁皮的镀层损坏后,铁更容易腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属化学腐蚀的实质是M-ne-=Mn+,电子直接由氧化剂提供 |
| B.金属在潮湿的空气中腐蚀的实质是M+nH2O=M(OH)n+n/2H2↑ |
| C.金属的化学腐蚀必须在酸性条件下进行,以析出H2为主 |
| D.在潮湿的强酸性环境下,金属的电化学腐蚀主要以正极上析出H2为主 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
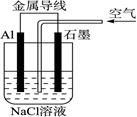
| A.铝是负极,铝片上析出无色气体 |
| B.溶液中两电极间产生白色沉淀 |
| C.溶液中先产生白色沉淀,最后沉淀溶解 |
| D.石墨是正极,石墨棒上析出黄绿色气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com