
(17分)某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

可选药品:浓硝酸、3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应。
2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③、④、⑥中盛放的药品依次是___________。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后___________。
(3)装置①中发生反应的化学方程式是___________。
(4)装置②的作用是 ,发生反应的化学方程式是___________。
(5)该小组得出的结论所依据的实验现象是___________。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是(选填序号字母) ___________。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通人浓硝酸与铜反应产生的气体,观察颜色变化
科目:高中化学 来源: 题型:
(17分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题:
⑴首先根据上图所示,组装实验装置,并在加入试剂前先进行 操作。
⑵烧杯中用NaOH溶液吸收的物质是: (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是: 。
⑶加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的
(填仪器名称)起到了确保硫酸体积保持不变的作用。
⑷将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行 、 、 后称量硫酸钡的质量为13.98g,请计算能与铜反应的硫酸的浓度最低是 。
⑸有的同学提出在上面⑷中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
(17分)某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应。
2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③、④、⑥中盛放的药品依次是___________。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后___________。
(3)装置①中发生反应的化学方程式是___________。
(4)装置②的作用是 ,发生反应的化学方程式是___________。
(5)该小组得出的结论所依据的实验现象是___________。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是(选填序号字母) ___________。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通人浓硝酸与铜反应产生的气体,观察颜色变化
查看答案和解析>>
科目:高中化学 来源:2011届黑龙江省哈三中等四校高三第一次高考模拟联考(理综)化学部分 题型:实验题
(17分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题: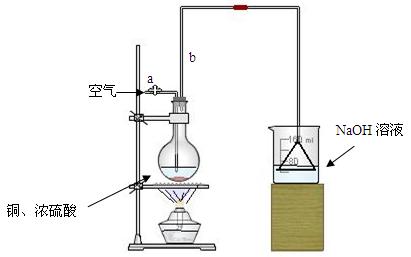
⑴首先根据上图所示,组装实验装置,并在加入试剂前先进行 操作。
⑵烧杯中用NaOH溶液吸收的物质是: (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是: 。
⑶加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的
(填仪器名称)起到了确保硫酸体积保持不变的作用。
⑷将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行 、 、 后称量硫酸钡的质量为13.98g,请计算能与铜反应的硫酸的浓度最低是 。
⑸有的同学提出在上面⑷中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
(共17分)(传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。随着DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)的发明和使用,这一问题有了很大程度的改善。某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。实验步骤如下:
⑴用 (填仪器名称)量取10.00mL氨水样品,在 (填仪器名称)中用一定量蒸馏水稀释并 后转移(含洗涤液)到
100mL (填仪器名称)中,用 (填仪器名称)加蒸馏水定容、混匀后,将所得溶液装入试剂瓶备用。
 ⑵量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。
⑵量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。
如果锥形瓶中含有少量蒸馏水,是否会影响测量结果 (填“是”、“否”、“不能确定”),
⑶向锥形瓶中滴加0.1000mol/L的盐酸,计算机屏幕上显 示出溶液导电能力与加入盐酸体积关系的曲线图
(见右)。
①滴定管盛放盐酸前,要先 ,
再 用少量蒸馏水 ,
再用 ,然后才 能盛放盐酸。滴定管中加入盐酸、排净 后,凹液面的最低点应处于滴定管的 。
②氨水与盐酸反应的离子方程式为 。
③简述判断滴定中点的理由 。
④该氨水样品的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com