
分析 (1)①A.升高温度,平衡向逆反应方向移动,则转化率减小;
B.使用催化剂平衡不移动,转化率不变;
C.增大压强平衡向正反应方向移动,转化率增大;
D.循环利用和不断补充氮气,可使平衡向正反应方向移动,转化率增大;
②设起始时H2的物质的量为3mol,N2为1mol,平衡时N2转化了xmol,
N2(g)+3H2(g)?2NH3(g)
起始:1mol 3mol 0
转化:xmol 3xmol 2xmol
平衡:(1-x)mol (3-3x)mol 2xmol
则$\frac{2x}{1-x+3-3x+2x}$=$\frac{1}{7}$
x=0.25,由此分析解答;
(2)①计算氨气的浓度变化,根据n=cV计算物质的量;
②根据方程式得出反应的关系式,可根据关系式计算.
解答 解:(1)①A.升高温度,平衡向逆反应方向移动,则转化率减小,故A错误;
B.使用催化剂平衡不移动,转化率不变,故B错误;
C.增大压强平衡向正反应方向移动,转化率增大,故C正确;
D.循环利用和不断补充氮气,可使平衡向正反应方向移动,转化率增大,故D正确.
故答案为:CD;
②设起始时H2的物质的量为3mol,N2为1mol,平衡时N2转化了xmol,
N2(g)+3H2(g)?2NH3(g)
起始:1mol 3mol 0
转化:xmol 3xmol 2xmol
平衡:(1-x)mol (3-3x)mol 2xmol
则$\frac{2x}{1-x+3-3x+2x}$=$\frac{1}{7}$
x=0.25,
此时N2的转化率为$\frac{0.25}{1}$×100%=25%,
故答案为:25%;
(2)①n(NH3)=$\frac{(153-17)mg•{L}^{-1}}{17g•mo{l}^{-1}}$×10-3g/mg×600m3×103L/m3=4800mol,
故答案为:4800;
②根据下列发生的主反应:
4NH3+5O2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$4NO+6H2O,4NO+3O2+2H2O=4HNO3
得主反应中氨气与氧气的物质的量有如下关系式:NH3~2O2
n(O2)主反应=4800 mol×90%×2=8640 mol
根据下列副反应:
4NH3+3O2=2N2+6H2O
n(O2)副反应=4800 mol×10%×$\frac{3}{4}$=360mol
V(空气)=(8640+360)mol×22.4L/mol×10-3m3/L÷20%=1008m3
故答案为:1008.
点评 本题考查化学平衡的计算,题目较为综合,且难度较大,易错点为(2),注意根据质量守恒利用关系法计算.


科目:高中化学 来源: 题型:解答题
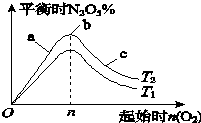 某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.
某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
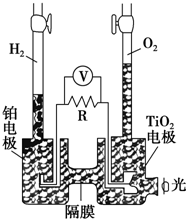 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )| A. | 该装置只能将光能转化为电能 | |
| B. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LKOH溶液.整个实验过程溶液中c(OH-)的变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LKOH溶液.整个实验过程溶液中c(OH-)的变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )| A. | a点对应溶液中含有的分子有H2O、HClO、HCl、Cl2 | |
| B. | b点对应溶液中:c(H+)>c(Cl-)>c(HClO)>c(ClO-)>c(OH-) | |
| C. | c点对应溶液中:c(K+)=c(Cl-)+c(ClO-)+c(HClO) | |
| D. | 实验过程中可以用pH试纸测定溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O | B. | 硫酸 | C. | NaOH(s) | D. | Na2SO4(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2SO4 | B. | H2SO4 | C. | Ba(OH)2 | D. | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电源的负极就是阴极 | |
| B. | 与直流电源正极相连的是电解池的阴极 | |
| C. | 与直流电源负极相连的电极上发生还原反应 | |
| D. | 阳极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
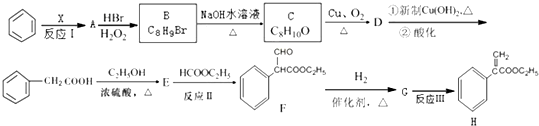
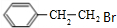 ;E的分子式为C10H12O2;F中含氧官能团的名称是醛基、酯基.
;E的分子式为C10H12O2;F中含氧官能团的名称是醛基、酯基. .
.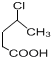 制备
制备 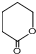 的合成路线流程
的合成路线流程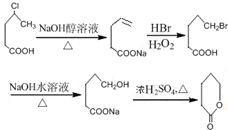 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com