
【化学-----化学与技术】
玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂有苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中____加入甲醛,且反应釜应装有____装置。K^S*5U.C#O%下
(2)玻璃纤维由玻璃拉丝得到。普通玻璃是由石英砂、______和石灰石(或长石)高温熔融而成,主要反应的化学方程式为_____________________________________。
(3)玻璃钢中玻璃纤维的作用是__________。玻璃钢具有___________等优异性能(写出亮点即可)。
(4)下列处理废旧热固性酚醛塑料的做法合理的是_________。
a.深埋 b.粉碎后用作树脂填料
c.用作燃料 d.用有机溶剂将其溶解,回收树脂
【解析】(1)为防止温度过高,应间歇性加入甲醛,并且有散热装置
(2) 利用碱石灰、纯碱、石英砂生成波兰的方程式为
Na2CO3+SiO2
 Na2SiO3+CO2 CaCO3+SiO2
Na2SiO3+CO2 CaCO3+SiO2 CaSiO3+CO2
CaSiO3+CO2
(3) 玻璃钢是将玻璃纤维和高分子材料复合而成的复合材料,其中玻璃纤维的作用是增强体 ,合成材料是基体;他的优点有: 强度高、质量轻、耐腐蚀、抗冲击、绝缘性能好等优良性能
(4)废旧合成材料的再生利用主要是三条途径:①通过再生和改性,重新做成多种有用的材料和制品;②采用热裂解或化学处理方法使其分解,用于制备多种化工原料;③将废旧的聚合物作为燃料回收利用热能;故b、c正确。因为塑料深埋地下一百年也不会腐烂,造成严重的白色污染,故a错;酚醛塑料不能溶解于有机溶剂,故d错。
【答案】
(1)间歇性 散热
(2) 纯碱 Na2CO3+SiO2 Na2SiO3+CO2 CaCO3+SiO2
Na2SiO3+CO2 CaCO3+SiO2 CaSiO3+CO2
CaSiO3+CO2
(3) 增强体 强度高、质量 轻、耐腐蚀、抗冲击、绝缘性能好等
轻、耐腐蚀、抗冲击、绝缘性能好等
(4)b、c


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是 ( )
A. 已知2H2(g)+O2(g)=2H2O(l) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为483.6 kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知2C(s)+2O2(g)=2CO2(g) ΔH1 2C(s)+O2(g)=2CO(g) ΔH2 则ΔH1>ΔH2
D.已知Ni(CO)4(s)=Ni(s)+4CO(g) ΔH=Q kJ·mol-1,则Ni(s)+4CO(g)=Ni(CO)4(s) ΔH=-Q kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——选修2:化学与技术](15分)
磷矿石主要以磷酸钙[Ca3(PO4)2·H2O]和磷灰石 [Ca5F(PO4)3、Ca5(OH)(PO4)3]等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程。
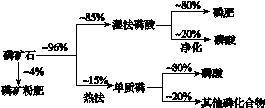
(a)
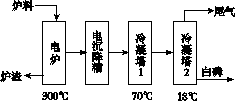
(b)
部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,有还原性 |
| SiF4 | -90 | -86 | 易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的________%。
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为________________________________________________________________________。
现有1 t折合含有P2O5约30%的磷灰石,最多可制得85%的商品磷酸________t。
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是________(填化学式),冷凝塔1的主要沉积物是________,冷凝塔2的主要沉积物是________。
(4)尾气中主要含有____________________,还含有少量的PH3、H2S和HF等。将尾气先通入纯碱溶液,可除去____________;再通入次氯酸钠溶液,可除去________。(均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
水处理技术在生产、生活中应用广泛。
(1)含有较多 离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为 (写出一个即可 )。
)。
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过
(填“RH”或“ROH”)型离子交换树脂,原因是 。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为 。电渗析法净化水时,使离子通过半透膜的推动力是 。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质或应用的说法不正确的是
A.二氧化硅是生产光纤制 品的基本原料
品的基本原料
B.水玻璃可用于生产黏合剂和防火剂
C.盐析可提纯蛋白质并保持其生理活性
D.石油分馏可获得乙烯、丙烯和丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤 如下:
如下:

请回答下列问题:
硫酸与二氧化钛反应的化学方程式是____________________________________。
(1) 向滤液I中加入铁粉,发生反应的离子方程式为:_________________________、____________________。
(2) 在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。水 解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_______________________________________
解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_______________________________________ ________。
________。
过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、___________、______________、_______________________(填化学式),减少废物排放。
(4)A可用于生产红色颜料(Fe2O3),其方法是 :将556a kgA(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
:将556a kgA(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式: 、 。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。①导致溶液温度降低的原因可能是 ;②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为 ;③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是 。
(3)能用于测定硫酸尾气中SO2含量的是 。(填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是
A.蛋白质遇硫酸钠溶液变性 B. 天然气的主要成分是甲烷
C.涤纶、锦纶、蚕丝都属于合成纤维 D. 植物油不能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中有CO、H2、O2共16.5g和足量的Na2O2,用电火花引燃,使其完全反应,Na2O2增重7.5g,则原混合气体中O2的质量分数是( )
A.54.5% B.40%
C.36% D.33.3%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com