
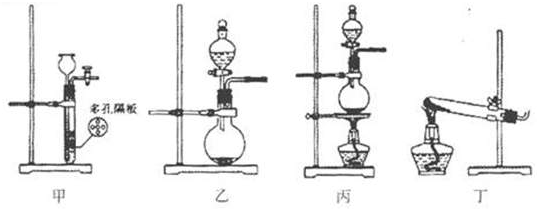
| 气体 | 试剂 | 装置 |
| Cl2 | ||
| SO2 |
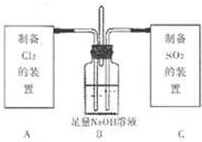
| ||
| ||


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| △ |
| △ |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量Fe(NO3)2固体于试管中, 加热分解. |
说明分解产生的气体中含N02. |
| 步骤2:将产生的气体依次通过盛有足量 |
说明分解产生的气体中含 02. |
查看答案和解析>>
科目:高中化学 来源: 题型:
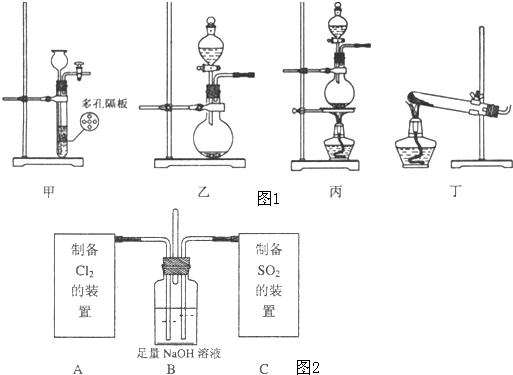
| 气体 | 试剂 | 装置 |
| Cl2 | ||
| SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com