
【题目】决定化学反应速率的主要因素是( )
A.反应物的性质
B.反应温度
C.催化剂
D.反应物的浓度
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,七种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答:
(1)x在元索周期表的位置是________________________。
(2)y的最高价氧化物对应的水化物与其氢化物反应,产物中含有化学键的类型为________________。
(3)d的单质在空气中充分燃烧,所得产物的电子式为________;7.8g该产物与足量的水完全反应,转移电子的数目为____________________。
(4)z、e、f的简单离子半径由大到小的顺序为_______________(用离子符号表示)。
(5)能说明g的非金属性比f强的实验事实是________________(列举一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)被誉为第三代半导体的明屋元素,广泛应用于电子工业。Ga位于周期表的第四周期,与A1同主族,主要存在Ga3+、GaO2-两种离子形态。
(1)请画出Ga的原子结构示意图___________。
(2)请写出Ga2O3溶解在NaOH溶液中的离子方程式_________________。
(3)氮化镓(GaN)可用于制作蓝色LED光源。GaN的传统工艺是用GaCl3与NH3反应来制备,新工艺则采用金属Ga与NH3在一定条件下来合成。已知:
①GaCl3(s)+NH3(g)=GaN(s)+3HCl(g) H1=+180kJ/mol
②2Ga(s)+6HCl(g)=2GaCl3(s)+3H2(g)H2=-492kJ/mol
③Ga(s)+NH3(g)=GaN(s)+3/2H2(g) H3
由上述反应可知H3=_____________。
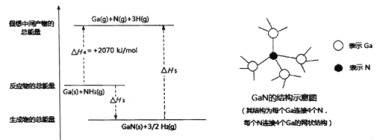
已知H-H的键能为436kJ/mol,结合上图分析,1molGaN含有_____molGa-N键,拆开lmolGa-N键所需能量为______kJ。
(4)工业上多用电解精炼法提纯镓。具体原理如下图所示:
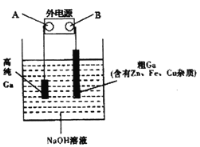
已知:金属的活动性Zn>Ga>Fe>Cu
①A为电源的_____极,电解精炼镓时产生阳极泥的主要成分是___________。
②电解过程中阳极产生的离子迁移到达阴极并在阴极放电析出高纯镓。请写出电解过程的阴极的电极反应_______________。
③电解过程中需控制合适的电压,若电压太高时阴极会产生H2导致电解效率下降。若外电路通过0.4mole-时,阴极得到7.0g的镓。则该电解装置的电解效率η=___________。(η=生成目标产物消耗的电子数÷转移的电子总数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质属于同系物的是 ( )
A.CH2=CH2和CH2=CHCH=CH2 B.CH3CH2Cl和CH2ClCH2CH2Cl
C.C2H5OH和CH4O D.CH3COOH和C17H33COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴越小组对其组成进行探究。
已知Cu2O在酸性溶液中会发生歧化反应:Cu2O+2H+=Cu+Cu2++H2O。
方案一:
(1)学生甲取少量样品于烧杯中,加入过量浓硝酸,产生一种红棕色的气体。由此可得出样品中一定含有_______,写出产生上述气体的化学方程式_____________。
(2)进一步探究样品中另一种成分。实验操作步骤为:取少量上述反应后溶液,加入______(填化学式)溶液,观察现象。
方案二:
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的____。
A.若固体全部溶解,说明样品一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
方案三:
学生丙利用下图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:
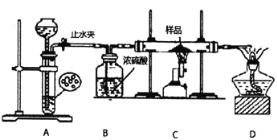
(4)装置A是氢气的发生装置,可以使用的药品是______(填选项)。
A.氢氧化钠溶液和铝片 B.稀硝酸和铁片 C.稀硫酸利锌片 D.浓硫酸和镁片
(5)下列实验步骤的先后顺序是_____(填序号)。
①打开止水夹 ②关闭止水夹 ③点燃C处的酒精喷灯
④熄灭C处的酒精喷灯 ⑤收集氢气并验纯
(6)假设样品全部参加反应生成相应金属单质,若实验前样品的质量为15.2g,实验后称得装置C中固体的质最为12.0g。则样品的组成是(若有多种成分,则须求出各成分的质量)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境已成为当前和未来的全球性的重大课题之一,下列因为人类生产对环境破坏而带来的后果是( )
①土地沙漠化 ②酸雨 ③水资源危机 ④南极上抽样空洞 ⑤沙尘暴.
A.①②⑤
B.①②④⑤
C.②⑤
D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表原子序数依次增大的前四周期元素,其中A和C为同一主族,C常用于制作半导体器件和集成电路,B的简单氢化物的水溶液呈碱性,E元素的正三价离子的3d亚层为半充满,D被称为“未来金属”,其重量轻、强度高、耐腐蚀,其在周期表中位于第4周期、第ⅣB族。
(1)A、B、C三种元素的第一电离能由小到大的顺序为______________________,电负性由小到大的顺序为____________________。
(2)B的简单氢化物易液化的原因是_______________;BH4+中B原子的杂化方式为___________,空间构型为__________________。
(3)E元素基态原子的电子排布式为____________________________________。
(4)B和C形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于__________________晶体。
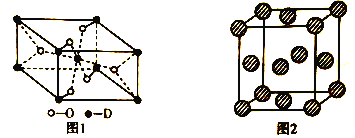
(5)D有多种氧化物,其中一种氧化物的晶胞结构如图1所示,则该晶体中D的配位数为__________________;图2为E的一种面心立方晶胞结构,若晶胞的边长为acm,NA表示阿伏加德罗常数的值,则E的密度为__________________g·cm-3(用含a和NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com