
下列有关叙述正确的是( )
A.铝和铁在常温下遇硫酸或硝酸发生钝化现象
B.金属钠除保存在煤油中,也可以保存在汽油中
C.湿法冶炼就是指金属在溶液中的置换反应,如金属钠置换硫酸铜溶液中的铜
D.涂油层、电镀金属层、制合金等都是保护金属的措施
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述正确的是
H++CH3COO-,下列叙述正确的是
A.0.10mol/L醋酸溶液中粒子浓度的关系满足:
c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)
B.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
C.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L H2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是________________________________________________________________________,
乙的电子式是________________________________________________________________________。
(2)甲与水反应的化学方程式是________________________________________________________________________
________________________________________________________________________。
(3)气体丙与金属镁反应的产物是 Mg3N2 (用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式________________________________________________________________________
________________________________________________________________________。
有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之 取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O (已知Cu2O+2H+===Cu+Cu2++H2O)。
(5)甲与乙之间 可能 (填“可能”或“不可能”)发生反应产生H2,判断理由是 AlH3中氢元素的化合价为-1价,NH3中含有+1价的氢元素,二者可发生氧化还原反应产生H2 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:21世纪教育网版权所有

(1)MgCO3与稀硫酸反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(2)加入H2O2氧化时,发生反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(3)滤渣2的成分是 Fe(OH)3 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
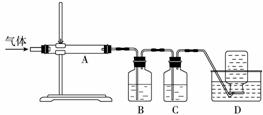
①D中收集的气体可以是 CO (填化学式)。
②B中盛放的溶液可以是 d (填字母)。
a.NaOH溶液 b.Na2CO3溶液
c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将1.12 g铁粉加入25 mL 2 mol/L氯化铁溶液中充分反应后,结果是( )
A.铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变
B.往溶液中滴入无色KSCN溶液,溶液变红色
C.Fe2+和Fe3+物质的量之比为5∶1
D.氧化产物和还原产物的物质的量之比为2∶ 5
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种单质组成的合金A,为分析其成分,用此合金进行一系列实验,其过程及发生反应的现象如下图所示。

填写下列空白:
(1)A中所含单质为 Fe、Al、Si、C (写化学式)。
(2)写出A中的某单质与烧碱溶液反应的离子方程式
________________________________________________________________________
________________________________________________________________________。
(3)若用长滴管向浅绿色溶液H中加入NaOH溶液产生的现象是________________________________________________________________________
________________________________________________________________________。
(4)写出固体F与硝酸反应的化学方程式,并标出电子转移的方向和数目:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890kJ·mol-1 现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是
A.1︰1 B.1︰3 C.1︰4 D.2︰3
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下有浓度均为0.5mol/L的四种溶液:①Na2CO3;②NaHCO3;③HCl;④NH3·H2O。
(1)上述溶液中,可发生水解的是________(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为________________________________________。
(3)向溶液④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填“增大”、“减小”、“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”、“等于”),此时溶液中离子浓度由大到小的顺序是______________________。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机化合物的结构与碳原子的成键方式有关。碳原子的结构特点决定了它与另外的原子结合时以形成共价键为主。下列说法正确的 ( )
①依据成键原子间共用电子的对数可将共价键分为单键、双键、叁键
②依据共用电子是否偏向于某一成键原子,可将共价键分为极性键和非极性键
③碳原子不仅彼此间可以成键,还可以与其他元素的原子成键
④碳原子成键方式的多样性使得有机化合物普遍存在着同分异构现象,常见的同分异构有碳骨架异构、官能团位置异构和官能团类型异构等。
A . ①②③ B.①②④ C. ②③ D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com