
| A、用食盐、水和乙烯为原料可以合成聚氯乙烯 |
| B、用氯气和乙炔为原料可以直接合成聚氯乙烯 |
| C、合成聚氯乙烯一定涉及氧化还原反应 |
| D、合成聚氯乙烯一定涉及加成聚合反应 |


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m4 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t8 | 16.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO32-、Na+、SO42-、H+ |
| B、Cu2+、SO42-、H+、Cl- |
| C、K+、OH-、NO3-、HCO3- |
| D、Al3+、NO3-、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、缩小体积 |
| B、充入更多的NO |
| C、体积增大到原来的2倍 |
| D、升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰石的分解反应 |
| B、铝与稀盐酸反应 |
| C、Ba(OH)2?8H2O 与NH4Cl反应 |
| D、NaOH与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 |
| B、分子式符合C5H11Cl的化合物有6种 |
| C、已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为3种 |
D、菲的结构简式为 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 定量测定化学反应速率 |
B、 验证钠与水反映的热效应 |
C、 加热d即可进行乙醇的催化氧化实验 |
D、 比较Fe3+和Cu2+对H2O2分解的催化效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
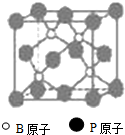 (物质结构与性质)磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.
(物质结构与性质)磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com