
| A. | 长期大量服用阿司匹林可预防疾病,没有毒副作用 | |
| B. | 碘酒能使蛋白质变性,常用于外敷消毒 | |
| C. | 使用青霉素可直接静脉注射,不需进行皮肤敏感试验 | |
| D. | 随着平价药房的开设,生病了都可以到药店自己买药服用 |
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | X和Y的总能量一定高于M和N的总能量 | |
| B. | X能量一定高于Y | |
| C. | 因该反应为放热反应,故不必加热就可发生 | |
| D. | Y能量一定高于N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲酸乙酯 | B. | 乙酸甲酯 | C. | 乙酸丙酯 | D. | 丙酸丁酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
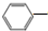 CH2CH3(g)+Cl2(g)$\stackrel{催化剂}{?}$
CH2CH3(g)+Cl2(g)$\stackrel{催化剂}{?}$ CHCl-CH3(g)+HCl(g)△H>0
CHCl-CH3(g)+HCl(g)△H>0| 时间/(min) | 0 | 2 | 5 | 6 | 9 | 10 |
| χ(乙苯) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
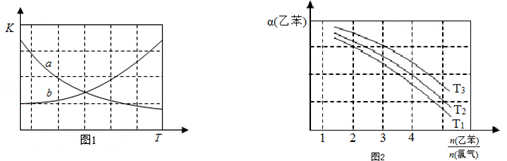
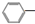 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)△H=+124kJ/mol
CH=CH2(g)+H2(g)△H=+124kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:实验题
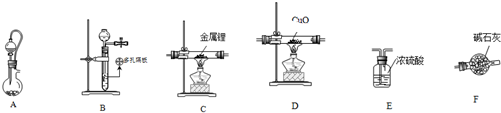
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素的最高正化合价依次升高 | |
| C. | B、C、N、O、F原子半径依次增大 | |
| D. | Li、Na、K、Rb的金属性依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com