
����Ŀ������������ȷ����( )
�� ���д���AlO2-����Һ�У�NH4+��NO3-��H+��Cl-���Դ�������
�� 0.1 molL-1��AlCl3��Һ�У�Na+��K+��SO42-��HCO3-���Դ�������
�� ��AlCl3��Һ�м��������ϡ��ˮ��������Ӧ��Al3++4NH3H2O=AlO2-+4NH4++2H2O
�� ���������ܷų�H2����Һ�У�Ca2+��Fe2+��Cl-��NO3-һ���ܹ���������
�� ��NaOH��Һ��ȥ�������������Ĥ��Al2O3+2OH-=2AlO2-+H2O
�� �������ȷ�Ӧԭ�����ܷ�����Ӧ2Al+3MgO![]() 3Mg+Al2O3
3Mg+Al2O3
�� ��������Һ�м������Ba(OH)2��Һ��������Ӧ��2SO42-+2Ba2++Al3++4OH-=2BaSO4��+AlO2-+2H2O
�� �����£��������ڹ���Ũ���ᣬҲ�����ڹ���NaOH��Һ
A. �ݢ� B. �ڢۢ� C. �ܢݢ� D. �ڢߢ�
���𰸡�A
��������
AlO2-ֻ�ܴ����ڼ�����Һ�У�����H+���Է�Ӧ��Al3+��HCO3-����˫ˮ�ⷴӦ�������������������Ͷ�����̼���壻AlCl3��Һ�м��������ϡ��ˮ�������������������Ȼ�������������ܷų�H2����Һ�����Ի�ǿ������������������������Һ��Ӧ����ƫ�����ƣ�þ�Ļ����Դ�������Al��MgO����Ӧ����������Һ�м������Ba(OH)2��Һ����ƫ����غ����ᱵ�����������£�����Ũ�����жۻ���
AlO2-ֻ�ܴ����ڼ�����Һ�У�����H+���Է�Ӧ�����д���AlO2-����Һ�������ܺ��д�����H+������������Al3+��HCO3-����˫ˮ�ⷴӦ�������������������Ͷ�����̼���壬AlCl3��Һ�в��ܺ��д�����HCO3-����������AlCl3��Һ�м��������ϡ��ˮ�������������������Ȼ������Ӧ���ӷ���ʽ��Al3++3NH3H2O=Al(OH)3![]() +3NH4+���������������������ܷų�H2����Һ�����Ի�ǿ���ԣ��������ᷴӦ���ܷų����������������£�Fe2+��NO3-����������ԭ��Ӧ��ǿ���������£��������Ӳ��ܴ������档��������������������������Һ��Ӧ����ƫ�����ƣ���Ӧ���ӷ���ʽ��Al2O3+2OH-=2AlO2-+H2O��������ȷ��þ�Ļ����Դ�������Al��MgO����Ӧ��������������������Һ�м������Ba(OH)2��Һ����ƫ����غ����ᱵ��������Ӧ���ӷ���ʽ��2SO42-+2Ba2++Al3++4OH-=2BaSO4��+AlO2-+2H2O��������ȷ�������£�����Ũ�����жۻ���������Ũ�������ʢ��������ѡA��
+3NH4+���������������������ܷų�H2����Һ�����Ի�ǿ���ԣ��������ᷴӦ���ܷų����������������£�Fe2+��NO3-����������ԭ��Ӧ��ǿ���������£��������Ӳ��ܴ������档��������������������������Һ��Ӧ����ƫ�����ƣ���Ӧ���ӷ���ʽ��Al2O3+2OH-=2AlO2-+H2O��������ȷ��þ�Ļ����Դ�������Al��MgO����Ӧ��������������������Һ�м������Ba(OH)2��Һ����ƫ����غ����ᱵ��������Ӧ���ӷ���ʽ��2SO42-+2Ba2++Al3++4OH-=2BaSO4��+AlO2-+2H2O��������ȷ�������£�����Ũ�����жۻ���������Ũ�������ʢ��������ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������ĵ��볣�����£�K(CH3COOH)��1.8��10��5�� K1(H2CO3)��4.4��10��7��K2(H2CO3)��4.7��10��11��K(HClO)��4.0��10��8��
I.��1�������£�0.1mol��L��1������������Һ����CH3COONa��Һ ��Na2CO3��Һ ��NaClO��Һ�� ��pH�ɴ�С��˳����________________������ţ���
��2����NaClO��Һ��ͨ������CO2�����ӷ�Ӧ����ʽΪ___________________________________��
II. �����£���25.00 mL 0.1000 mol��L��1Na2CO3��Һ�еμ�0.1000 mol��L��1���ᣬ��Һ��pH�仯������ͼ��ʾ��
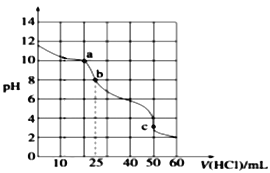
��3��a����Һ��c(CO32��) :c(HCO3��) =______________��
��4��b����Һ������Ϊ______________��b����Һ�ʼ��Ե�ԭ��Ϊ_______________________��
��5��b��c�����е����ӷ�Ӧ����ʽΪ___________________________________________��
III. ����ij̼���ƺ��������ƵĻ����Һ��Ϊ�ⶨ���и��ɷֵ�Ũ�ȣ�ijʵ��С����������·�������������(�����ͼ�ش���������)��
����ȡ20.00mL��Ʒ��Һ����ƿ�У����뼸�η�̪��
����c mol��L��1�ı�������Һ�ζ����յ㣻
���ظ�����ʵ�飬������������ƽ��ֵΪV1 mL��
����ȡ20.00mL��Ʒ��Һ����ƿ�У����뼸�μ��ȣ�
����c mol��L��1�ı�������Һ�ζ����յ㣻
���ظ�����ʵ�飬������������ƽ��ֵΪV2 mL��
��6������������ȡ��Ʒ��Һ��������Ϊ___________________��
��7���������յ�����Ϊ________________________________________________________________��
��8����Ʒ��Һ��̼���ƺ������������ʵ���Ũ��֮��Ϊ___________�����ú�c��V1��V2��ʽ�ӱ�ʾ�������������еζ�����ʱ���Ӷ���������c(Na2CO3)_____��ѡ�ƫ����ƫС��������Ӱ�족����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ڻ�ѧ�仯����
A.�������佺����������ЧӦB.���������Ũ���ᷢ���ۻ�
C.ͨ��ʯ�͵ķ����ȡ����D.��������Һ��ʳ��ˮ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ʵ�����ý���ͭ��ϡ������ȡNO�����ӷ���ʽΪ______________________��
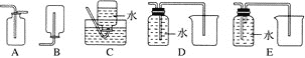
(2)NO���ж����壬ijѧ��Ϊ��ֹ��Ⱦ���÷�Һ©�����ձ�װ����һ���ġ����濪���á������ͣ��NO���巢��װ�ã���ͼ����ʾ��

��ʵ������û��ͭ˿����ֻ��Сͭ������ʹ������װ�ý���ʵ��ʱ������˿״���ϰ���ͭ���Դ���ͭ˿����ʵ�飬����˿״���ϵijɷֿ�����________(�����)��
A���� B���� C���� D������
�ڴ�Һ©���Ļ���ʹ��Ӧ���У��ڷ�Һ©����ʵ�ʿ����������Ǻ���ɫ�ģ�ԭ����__________(�ѧ����ʽ)��
(3)Ϊ֤��ͭ˿��ϡ���ᷴӦ���ɵ�ȷʵ��NO��ijѧ���������һ����ͼ����ʾ��װ����ȡNO����Ӧ��ʼ������U�ι��Ҷ˹۲쵽��ɫ��NO���塣
�ٳ������ܵ�������______________________________________________________��
���÷�Ӧֹͣ�IJ���������ԭ����__________________________________________��
(4)�����ռ�NO�����װ�ã���������________(�����)��
(5)��32.64 gͭ��140 mLһ��Ũ�ȵ����ᷴӦ��ͭ��ȫ�ܽ������NO��NO2��������ڱ�״���µ����Ϊ11.2 L����ش�
��NO�����Ϊ________ L��NO2�����Ϊ________ L��
�ڴ�����������ȫ���ͷź�����Һ�м���VmLamol��L��1��NaOH��Һ��ǡ��ʹ��Һ�е�Cu2��ȫ��ת���ɳ�������ԭ������Һ��Ũ��Ϊ________ mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��д���H����Fe3����SO42-����Һ�У������ܴ��������������(����)
A. NO3-B. Ba2��
C. CO32-D. AlO2-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������50Kg�Ľ����˴�Լ����2g����2g���������в����Ե��ʽ�����ʽ���ڣ�������Fe2+��Fe3+����ʽ�����������������ױ����գ���ƶѪ�߲�����ʱ��Ӧ���躬���������ӵĶ������Σ�����������(FeSO4)������ά����C����ʹʳ���е����������ӻ�ԭ�ɶ��������ӣ�����������������
(1) ������ά����C����ʹʳ�������������ӻ�ԭ�ɶ���������������仰ָ����ά����C����һ��Ӧ����_________��������________����
(2) ���ˮ�еμӱ��͵�FeCl3��Һ�Ʊ�Fe(OH)3���壬�������ӷ���ʽΪ��______________________��
(3) Ϊ����֤Fe3+�����ʣ�ij��ѧ��ȤС�����������ͼ��ʾ��һ��ʵ�飬ʵ�鷽����ƴ������_____(����ĸ)

A. �ܺ͢� B. ֻ�Т� C. �ۺ͢� D. �٢ڢ�
(4) ��֪��������Cl2>Br2>Fe3+����ԭ��Fe2+>Br->Cl-������1L 0.2mol��L-1��FeBr2��Һ��ͨ���״��������2.24L����������������________���˷�Ӧ�����ӷ���ʽ��____________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�����������ԭ��Ӧ�����ܴ���������ǣ�������
A.K+��H+��Fe2+��MnO4��
B.Fe3+��Ba2+��SO42����NO3��
C.Al3+��Na+��SO42����CO32��
D.Fe3+��H+��SO42����ClO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������о���������CH4��CO2��ת�������á�
��1����Ni��������������,CH4��CO2��Ӧ�ɻ�û���ԭ��CO��H2��
�ٻ�̬Ni��Χ�۵�������_________�ԳɶԵ��ӡ�
��CH4��CO2��H2�������й¶Ե��ӵ���_________.
��2��һ��������,CH4��CO2������H2O�γ���״�ṹ(��ͼ��ʾ)��ˮ���ᄃ��,����ز������±���CH4��H2O�γɵ�ˮ�����׳�����ȼ������
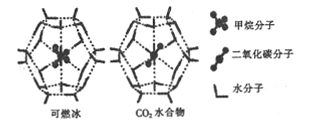
���� ���� | ����ֱ��/mm | ������H2O�Ľ����(E) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | y |
��CO2ˮ������Ӽ���ڵ�������������___________.
��Ϊ�������������ȼ����,��ѧ���Ѿ�֤������CO2�û�CH4����֪��ͼ����״�ṹ�Ŀ�ǻֱ��Ϊxnm,��������ͼ��,�����ʵĽṹ�����ʵĽǶȷ���:x_____0.512;y_______16.40��(����>����<"����=��)
��д��CH4��һ�ֵȵ�����: __________;SiO2��CO2�Ƿ�Ϊ�ȵ�����?_________(������������������),������________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������(����)
A. ��������ˮ��ӦB. ��̿��ˮú��
C. ����кͷ�ӦD. ����ˮ��Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com