
下图是实验室制取并验证SO2的某些性质的装置图。试回答:
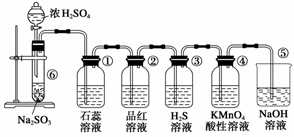
(1)在⑥中发生反应的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(2)在①中的实验现象为___________________________________________________,
此实验证明SO2是________气体。
(3)②中的品红溶液_____________________________________________________,
证明SO2有________________。
(4)③中的实验现象是_____________________________________________________,
证明SO2有____________性。
(5)④中的实验现象是___________________________________________________,
证明SO2有____________性。
(6)⑤的作用是_________________________________________________________,
反应的化学方程式为_____________________________________________________。
科目:高中化学 来源: 题型:
把淀粉和NaCl溶液装入半透膜袋内,浸入蒸馏水中进行渗析。试回答:
(1)证明淀粉未透过半透膜而Cl-已透过半透膜的实验方法是_______________ ___________________________________________________________________________。
(2)证明淀粉与NaCl溶液已分离完全的实验方法是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
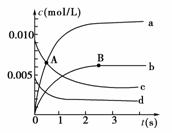
(1)A点处,v(正)________v(逆),A点正反应速率________B点正反应速率(用“大于”、“小于”或“等于”填空)。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________________。
(3)能说明该反应已经达到平衡状态的是________。
a.v(NO2)=2v(O2) B.容器内的压强保持不变
c.v逆(NO)=2v正(O2) D.容器内的密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
能证明SO2有漂白性的是( )
A.酸性KMnO4溶液中通入SO2后,紫色消失
B.显红色的酚酞溶液中通入SO2后,红色消失
C.品红溶液中通入SO2后,红色消失
D.氯水中通入SO2后,黄绿色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
强热条件下,硫酸亚铁固体发生分解:2FeSO4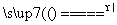 Fe2O3+SO2↑+SO3↑,如将此反应生成的气体通入BaCl2溶液中,则( )
Fe2O3+SO2↑+SO3↑,如将此反应生成的气体通入BaCl2溶液中,则( )
①析出BaSO3沉淀 ②析出BaSO4沉淀 ③逸出SO3气体 ④逸出SO2气体
A.①② B.①④ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
用足量的CO还原32.0 g某氧化物,将生成的气体通入足量澄清石灰水中,得到60 g沉淀,则该氧化物是( )
A.FeO B.Fe2O3
C.CuO D.Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某种牙膏中的摩擦剂是碳酸钙,可以用石灰石来制备,某同学设计了一种制备碳酸钙的实验方案,流程图为:

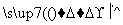

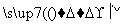

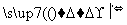

(1)请写出上述方案中有关反应的化学方程式:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(2)请你仍用石灰石为原料(其他试剂自选),设计另一种制备碳酸钙的实验方案,将你的实验方案用流程图表示出来:

你所设计的方案的优点是________________________________________________。
(3)检验牙膏中是否含有碳酸盐的实验方法是_________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
少量铁粉与100 mL 0.01 mol·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加CH3COONa固体 ③改用10 mL 0.1 mol·L-1盐酸
④滴入几滴硫酸铜溶液 ⑤升高温度(不考虑盐酸挥发)
A.①② B.②③ C.③⑤ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
|
|
|
|
等)生产Ni2O3。其工艺流程为:
 |

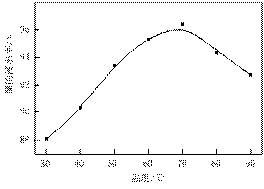
图Ⅰ 图Ⅱ
⑴根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为
。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
⑵工艺流程中“副产品”的化学式为 。
⑶已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。该实验方案合理吗?若合理,请说明理由;若不合理,请加以改正。__________________________________________。
⑷操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度
为 mol·L-1(常温时CaF2的溶度积常数为2.7×10-11)。抽滤装置中除了抽气泵、
安全瓶外,还需要的主要仪器有_____________________。
⑸电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com