
| n |
| V |
| ||
| ||
| 14.8g |
| 74g/mol |
| 0.2mol×44.8L |
| 2mol |
| 0.2mol |
| 0.2L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、SO2为0.6 mol/L,O2为0.3mol/L |
| B、SO2为0.4mol/L |
| C、SO3为0.6 mol/L |
| D、SO2、SO3均为0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、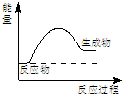 如图所示的是一个放热反应 |
| B、加入催化剂v(正)增大、v(逆)减小 |
| C、吸热反应只能在加热的条件下才能进行 |
| D、只有活化分子才能发生有效碰撞 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨生产过程增大氮气浓度,可以同时提高N2、H2的转化率 |
| B、硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
| C、电解精炼铜时,阳极溶解的金属的质量与阴极析出的金属的质量不相等 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
| B、目前中美日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率 |
| C、2005年10月12日发射成功的“神舟六号”载人飞船使用了大量的复合材料 |
| D、合成高分子材料的广泛应用是有百利而无一害 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com