解:(1)①由题意知,反应物是亚硫酸易与氧气,生成物是硫酸,所以反应方程式为2H
2SO
3+O
2=2H
2SO
4;
故答案为:2H
2SO
3+O
2=2H
2SO
4②活性炭的结构为疏松多孔,所以具有吸附性,能够吸附气体、色素、水中悬浮杂质等.
故答案为:吸附性;
③A、根据两物质的化学式SO
2和NO
2,可知两物质都是一种元素与氧元素形成的氧化物,故A正确;
B、根据化合物中各元素化合价代数和为0,可计算SO
2中S元素为+4价,NO
2中N元素为+4价,而非+2价,故B错误;
C、二氧化硫的相对分子质量大于二氧化氮的,根据ρ=
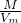
,相同条件下,V
m相同,所以其密度与相对分子质量有关,二氧化氮和二氧化硫的相对分子质量不同,所以密度不同,故C错误;
D、二氧化硫为无色有刺激性气味的气体,二氧化氮为红棕色气体,故D错误.
故选A.
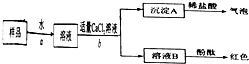
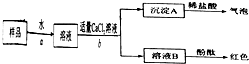
(2)①根据实验Ⅰ知,样品中含有碳酸钠,氢氧化钠是碱,能和空气的酸性气体二氧化碳反应生成碳酸钠和水.
2NaOH+CO
2=Na
2CO
3+H
2O.
故答案为:2NaOH+CO
2=Na
2CO
3+H
2O.
②该实验中用烧杯盛放液体,玻璃棒搅拌液体.
故答案为:烧杯和玻璃棒.
③氢氧化钙和碳酸钠反应生成氢氧化钠,会影响对NaOH存在的判断,所以不能用Ca(OH)
2代替CaCl
2.
故答案为:Ca(OH)
2+Na
2CO
3=CaCO
3↓+2NaOH,会影响对NaOH存在的判断
④A.测定沉淀A 的质量,沉淀中没有钠离子和氢氧根离子,所以不能直接得出氢氧化钠的质量,故A错误.
B、溶液B为氢氧化钠和氯化钠溶液的混合溶液,蒸发后所得固体为氢氧化钠和氯化钠混合物的质量而不是氢氧化钠的质量,无法完成样品中氢氧化钠质量分数的计算,故B错误;
C、混合溶液中的氯化钠不与稀硫酸反应,通过测量与氢氧化钠发生反应的硫酸的质量计算出氢氧化钠的质量,可以完成样品中氢氧化钠质量分数的计算,故C正确;
故选C.
分析:(1)①根据反应物、生成物写出相应的方程式;
②根据活性炭的结构疏松多孔,所以具有吸附性,能够吸附气体、色素、水中悬浮杂质等.
③根据两物质的化学式SO
2和NO
2,可知两物质都属于氧化物,其中S、N化合价都为+4价,二氧化硫的密度大于二氧化氮的密度;二氧化硫为无色有刺激性气味的气体,二氧化氮为红棕色气体;
(2)①根据实验Ⅰ知,样品中含有碳酸钠,氢氧化钠是碱,能和空气的酸性气体二氧化碳反应生成碳酸钠和水.
②该实验中用烧杯盛放液体,玻璃棒搅拌液体.
③氢氧化钙和碳酸钠反应生成氢氧化钠,会影响对NaOH存在的判断.
④根据能否求出氢氧化钠的质量判断.
点评:本题考查了二氧化硫和氢氧化钠的性质,难度不大,会根据ρ=
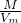
比较相同条件下不同气体的相对密度大小.

 请你与小王同学一道完成下列问题的分析解答:
请你与小王同学一道完成下列问题的分析解答: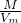 ,相同条件下,V m相同,所以其密度与相对分子质量有关,二氧化氮和二氧化硫的相对分子质量不同,所以密度不同,故C错误;
,相同条件下,V m相同,所以其密度与相对分子质量有关,二氧化氮和二氧化硫的相对分子质量不同,所以密度不同,故C错误;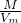 比较相同条件下不同气体的相对密度大小.
比较相同条件下不同气体的相对密度大小. 

 请你与小王同学一道完成下列问题的分析解答:
请你与小王同学一道完成下列问题的分析解答: