
| A. | 该合金中铜与镁的物质的量之比是2:1 | |
| B. | 可得到2.54 g沉淀 | |
| C. | 如果是铜铝合金,则产生的NO2 的体积不会是1344mL | |
| D. | 恰好全部沉淀时,加入NaOH溶液的体积是600 mL |
分析 A、假设在1.52 g铜镁合金中含有的Mg、Cu的物质的量分别是x、y,则根据质量守恒,可以建立24x+64y=1.52,根据化学方程式可建立(2x+2y)×22400=1344,解得x=0.01mol,y=0.02mol;
B、沉淀的质量等于合金的质量和氢氧根离子的质量,金属失去1mol的电子生成沉淀时就结合1mol的氢氧根离子;
C、铜铝合金中的铝遇到浓硝酸在常温下出现钝化现象;
D、根据原子守恒可以推导出关系式:Cu~Cu(OH)2~2NaOH,Mg~Mg(OH)2~2NaOH,于是计算出进行这两个反应消耗的NaOH的物质的量=0.01×2+0.02×2=0.06mol,但是考虑到硝酸是足量,应该还发生反应HNO3+NaOH=NaNO3+H2O,可见实际上完全沉淀时消耗的NaOH的物质的量要大于0.06mol.
解答 解:A、假设在1.52 g铜镁合金中含有的Mg、Cu的物质的量分别是x、y,则根据质量守恒,可以建立24x+64y=1.52,根据化学方程式可建立(2x+2y)×22400=1344,解得x=0.01mol,y=0.02mol,所以该合金中铜与镁的物质的量之比是2:1,故A正确;
B、沉淀的质量等于合金的质量和氢氧根离子的质量,金属失去1mol的电子生成沉淀时就结合1mol的氢氧根离子,所以沉淀质量为:1.52g+$\frac{1.344L}{22.4L/mol}×17g/mol$=2.54g,故B正确;
C、铜铝合金中的铝遇到浓硝酸在常温下出现钝化现象,所以产生的NO2只能靠铜来完成反应,所以实际产生的NO2气体体积应该小于1344mL,故C正确;
D、根据原子守恒可以推导出关系式:Cu~Cu(OH)2~2NaOH,Mg~Mg(OH)2~2NaOH,于是计算出进行这两个反应消耗的NaOH的物质的量=0.01×2+0.02×2=0.06mol,但是考虑到硝酸是足量,应该还发生反应HNO3+NaOH=NaNO3+H2O,可见实际上完全沉淀时消耗的NaOH的物质的量要大于0.06mol,相应的加入NaOH溶液的体积也应该大于600mL,故D错误;
故选:D.
点评 本题考查混合物的有关计算,题目难度中等,明确反应发生的实质为解答关键,注意根据守恒思想进行的解答,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:多选题
| A. | 氨水稀释后,溶液中 的值减小 的值减小 | |
| B. | 0.1mol•L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 | |
| C. | 电解精炼铜过程中,阳极质最的减少与阴极质量的增加一定相等 | |
| D. | 298K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 25℃时,若将pH=3的盐酸与pH=11的氨水混合后溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水) | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 结合H+的能力:CO32->HCO3->CN->HCOO- | |
| D. | 0.1mol/L的NaHCO3溶液中:c(H2CO3)+c(H+)=c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
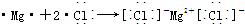 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
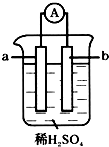 已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )
已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )| A. | 碳棒上有气体放出,溶液酸性变弱 | B. | a是正极,b是负极 | ||
| C. | 导线中有电子从a极到b极 | D. | a极上发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋壳浸泡在盐酸中产生气泡:CO32-+2H+═CO2↑+H2O | |
| B. | 将氨气通入硫酸溶液中:NH3+H+═NH4+ | |
| C. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 向碳酸氢铵溶液中加入足量的NaOH溶液:NH4++OH-═NH3•H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com