
【题目】汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染。
(1)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2(g) + O2(g) = 2NO(g) △H = +180.5 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是 。
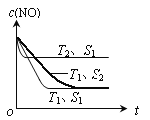
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2CO(g)+2NO(g) ![]() 2CO2(g)+N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g)+N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。

① 该反应的△H 0 (填“>”或“<”)。
② 若催化剂的表面积S1>S2 ,在右图中画出c (NO) 在T1、S2 条件下达到平衡过程中的变化曲线。
(3)在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:
![]()
时间/s | 0 | 1 | 2 | 3 | 4 |
c (NO)(×10-3 mol·L-1) | 1.00 | 0.50 | 0.20 | 0.10 | 0.10 |
c (CO)(×10-3 mol·L-1) | 3.00 | 2.50 | 2.20 | 2.10 | 2.10 |
不考虑温度变化对催化剂催化效率的影响,按要求完成以下计算(写出计算过程,只写出计算结果的不给分):
①计算前2s内的△c (CO2) ;
②计算前2s内的平均反应速率v (N2) ;
③计算达到平衡时NO的转化率。
【答案】(1)2H2(g)+2NO(g) =N2(g)+2H2O(l) △H =-752.1kJ·mol-1
(2 ①△c (CO2)= 0.80 mol·L-1;
②v (N2)= △c (N2)/ △t=0.20 mol·L-1·s-1;
③平衡时NO的转化率为(1.00-0.10)/1.00×100%=90%。
【解析】
试题分析:(1)①已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJmol-1
依据盖斯定律可知②-①得:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H,
△H=(-571.6kJ/mol)-180.5kJ/mol═-752.1kJ/mol;由于正反应放热(△H<0),且正反应方向气体体积减小,为熵减小的方向,即△S<0,△H-T△S<0,反应自发进行,所以T较小才可以,即低温下自发,故答案为:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1kJ/mol;
(2)①温度T2到达平衡的时间短,反应速率快,故温度T2>T1,温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,故答案为:<;
②催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为
 ,
,
(3) 2CO(g) + 2NO(g) ![]() 2CO2(g) + N2(g)
2CO2(g) + N2(g)
起始浓度(×10-3 mol·L-1) 3.00 1.00 0 0
2s末浓度(×10-3 mol·L-1) 2.20 0.20 0.80 0.40
2s变化浓度(×10-3 mol·L-1)0.80 0.80 0.80 0.40
平衡浓度(×10-3 mol·L-1) 2.10 0.10 0.90 0.45
①△c (CO2)= 0.80 mol·L-1,故答案为:0.80 mol·L-1;
②v (N2)= △c (N2)/ △t=0.20 mol·L-1·s-1,故答案为:0.20 mol·L-1·s-1;
③平衡时NO的转化率为(1.00-0.10)/1.00×100%=90%,故答案为:90%。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
①汽车尾气中氮氧化物与光化学烟雾的形成有关 ②大量燃烧含硫燃料是形成酸雨的主要原因 ③硅是太阳能电池和光导纤维的主要成分 ④减少CO2排放,可遏制全球气候变暖 ⑤纯铁比碳素钢易生锈
A.①③⑤ B.②③④ C.②④⑤ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【原创题】下列一起仪器的选用正确的是()
A.称量10.56gNa2CO3固体——用托盘天平
B.准确量取10.00mL的溶液——用50mL量筒
C.灼烧干海带至完全变成灰烬——用蒸发皿
D.过滤煮沸后的硬水——用普通漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )
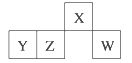
A. 原子半径:rW>rZ>rY>rX
B. 含Y元素的盐溶液一定显酸性
C. 最简单气态氢化物的热稳定性:Z>W
D. X与氢元素组成的化合物XH5与水反应可产生两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)Si3N4(s)+6CO(g)
(1)该反应的氧化剂是 ,其还原产物是 ;
(2)该反应的平衡常数表达式为K= ;
(3)若知上述反应为放热反应,则其反应热△H 0(填“>”、“<”或“=”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18molL﹣1min﹣1,则N2消耗速率为v(N2)= ;
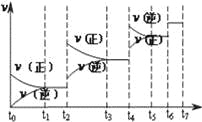
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的( )
A.已知C(s)+O2(g)═CO2(g)△H1;C(s)+![]() O2(g)═CO (g)△H2,则△H1>△H22
O2(g)═CO (g)△H2,则△H1>△H22
B.在稀溶液中,H+(aq)+OH﹣(aq)═H2O(l);△H=﹣57.3kJmol﹣1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热大于57.3 kJ
C.由C(石墨)═C(金刚石);△H=+1.90kJmol﹣1可知,金刚石比石墨稳定
D.在101kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧的热化学方程式为:2H2(g)+O2 (g)═2H2O(l);△H=﹣285.8kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.因SiO2不溶于水,故H2SiO3不是SiO2对应的酸或者SiO2不是H2SiO3的酸酐
B.CO2通入水玻璃,可以得到硅酸沉淀
C.SiO2是一种空间立体网状结构的晶体,熔点高,硬度大
D.氢氟酸能够腐蚀玻璃,故不能用玻璃瓶来装氢氟酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列的分离方法不正确的是( )
A. 用过滤的方法除去食盐水中的泥沙
B. 用蒸馏的方法将自来水制成蒸馏水
C. 用酒精萃取碘水中的碘
D. 用分液的方法除去四氯化碳中的水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com