
| A. | 检验溴乙烷中的溴:取溴乙烷加氢氧化钠溶液,加热,再加硝酸银溶液有浅黄色沉淀生成 | |
| B. | 检验葡萄糖:在硝酸银溶液中滴加稀氨水至沉淀恰好溶解再加少许葡萄糖溶液,水浴加热 | |
| C. | 检验乙醛:加入2% 硫酸铜溶液2 mL再加入2% NaOH溶液2 mL;加热至沸腾 | |
| D. | 实验室制乙烯:取浓硫酸和乙醇体积比1:3的溶液加热到170℃ |
分析 A.溴乙烷在碱性条件下水解,加入硝酸银可生成AgOH沉淀,干扰实验现象;
B.葡萄糖可与银氨溶液发生氧化还原反应,配制银氨溶液,最初生成的沉淀恰好溶解即可;
C.乙醛与氢氧化铜浊液的反应应在碱性条件下进行;
D.浓硫酸和乙醇体积比3:1.
解答 解:A.溴乙烷在碱性条件下水解,检验溴离子,应先加入硝酸酸化,防止加入硝酸银后生成AgOH沉淀,干扰实验现象,故A错误;
B.葡萄糖可与银氨溶液发生氧化还原反应,配制银氨溶液,最初生成的沉淀恰好溶解即可,操作符合要求,故B正确;
C.乙醛与氢氧化铜浊液的反应应在碱性条件下进行,应加入氢氧化钠稍过量,故C错误;
D.浓硫酸和乙醇体积比3:1,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握有机物的性质及有机实验的注意事项为解答的关键,侧重性质实验及实验技能的考查,题目难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子序数:X>Y>Z>W | |
| B. | 离子半径:W>X>Z | |
| C. | W分别与Y、Z形成的化合物中化学键类型不同 | |
| D. | 气态氢化物的稳定性:W<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各元素在元素周期表中的族序数:W=X>Y>Z | |
| B. | 最高价氧化物对应的水化物的酸性:W>Z | |
| C. | 离子半径:X>Y>Z | |
| D. | YW3不能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
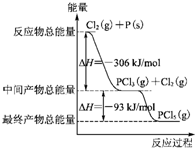 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
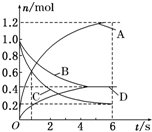 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 反应进行到1s时,v(A)=v(C) | |
| C. | 反应进行到6s时,B和D的物质的量浓度均为0.4mol•L-1 | |
| D. | 反应进行到6s时,B的平均反应速率为0.05mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
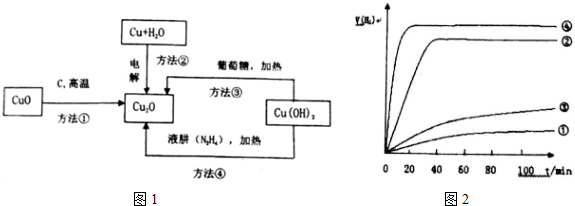
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某铜(Ⅱ)盐晶体组成可以表示为Ka[Cub(C2O4)c]•dH2O,其组成可通过下列实验测定:
某铜(Ⅱ)盐晶体组成可以表示为Ka[Cub(C2O4)c]•dH2O,其组成可通过下列实验测定:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3→Na++CO32- | B. | H2S→2H++S2- | ||
| C. | H2CO3→H++HCO3- | D. | NaHSO4→Na++H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com