
| A. | 42.0g | B. | 21.3g | C. | 7.1g | D. | 3.55g |
分析 n(Nal)=$\frac{90g}{150g/mol}$=0.6mol,n(Br2)=$\frac{40g}{160g/mol}$=0.25mol,发生反应2NaI+Br2=2NaBr+I2,反应后NaI剩余,再通入足量的氯气,发生2NaI+Cl2=2NaCl+I2,2NaBr+Cl2=2NaCl+Br2,结合反应的方程式解答.
解答 解:反应后NaI剩余,再通入足量的氯气,发生2NaI+Cl2=2NaCl+I2,2NaBr+Cl2=2NaCl+Br2,最终产物为NaCl,由质量守恒可知生成NaCl的物质的量为0.6mol,则被还原的氯气的物质的量为0.3mol,质量为0.3mol×71g/mol=21.3g,
故选B.
点评 本题考查氧化还原反应的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意从质量守恒的角度结合反应的化学方程式解答该题,难度中等.


科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若溶液中c(Cl-)=c(NH4+),则溶液一定呈中性 | |
| B. | 若c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶质一定为NH4Cl | |
| C. | 若c(OH-)>c(H+),则溶液中不可能存在:c(NH4+)>c(OH-)>c(Cl-)>c(H+) | |
| D. | 若溶质为NH4Cl、NH3•H2O,则一定存在:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾溶液与乙二酸(草酸)反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| B. | 在NH4HSO4溶液中慢慢滴入等物质的量的NaOH溶液:NH4++OH-═NH3•H2O | |
| C. | VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4-+H2O═5VO2++Mn2++2H+ | |
| D. | AgNO3溶液中加入过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| B. | 化学反应涉及化学键的断裂和生成,而且还伴随着能量的变化 | |
| C. | 化学反应速率的大小主要取决于反应物的本身性质 | |
| D. | CO2(g)+C(s)?2CO(g)△H>0,△S>0,该反应常温下不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
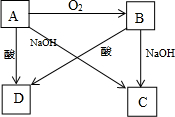
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作(或设计) | 实验现象 | 结论 |
| A | 向溶液中滴加经盐酸酸化的BaCl2溶液 | 溶液中产生白色沉淀 | 溶液中含有SO42- |
| B | 以镁、铝、氢氧化钠溶液构成原电池 | 镁表面有气泡产生 | 镁作原电池的负极 |
| C | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升化 |
| D | 向KI溶液中滴入少量溴水和苯,振荡、静置 | 上层溶液呈紫红色 | I-的还原性强于Br- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
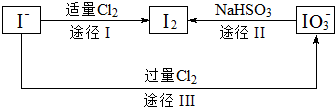
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com